NCERT Solutions For Class 11 Chemistry Chapter 12 Organic Chemistry Some Basic Principles and Techniques in Hindi - 2025-26
In NCERT Solutions Class 11 Chemistry Chapter 12 In Hindi, you’ll explore the basic ideas and methods behind organic chemistry, all explained in an easy-to-understand way. This chapter helps you understand how carbon compounds are formed, named, and studied—making a tricky topic much simpler.
 Table of Content
Table of ContentWith Vedantu’s detailed answers, you can clear up your doubts about IUPAC naming, isomerism, purification, and methods for analyzing organic compounds. Downloadable Hindi and English PDFs let you study anytime, boosting your confidence for exams. You’ll also find step-by-step solutions perfect for quick revision or deeper learning ahead of tests.
Feeling confused about which type of questions might come in the exam from this chapter? Use these Class 11 Chemistry NCERT Solutions to make your studies smoother and score better. Plus, this chapter carries 11 marks in your CBSE exam, so mastering it can really help improve your overall score!
NCERT Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry Some Basic Principles and Techniques in Hindi
1. निम्नलिखित यौगिकों में प्रत्येक कार्बन की संकरण अवस्था बताइए-
उत्तर:
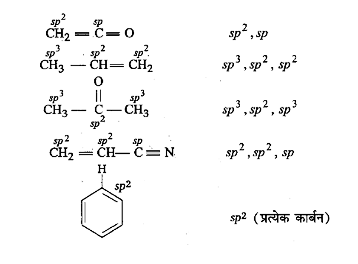
2. निम्नलिखित अणुओं में σ तथा π आबन्ध दर्शाइए-
$\mathrm{C}_{6} \mathrm{H}_{6}, \mathrm{C}_{6} \mathrm{H}_{12}, \mathrm{CH}_{2} \mathrm{Cl}_{2}, \mathrm{CH}_{2}=\mathrm{C}=\mathrm{CH}, \mathrm{CH}_{3} \mathrm{NO}_{2}, \mathrm{HCONHCH}_{3}$
उत्तर:
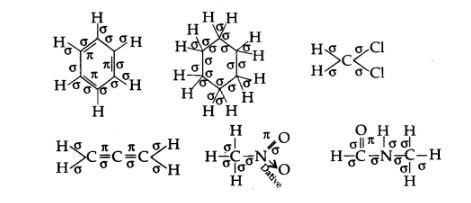
3. निम्नलिखित यौगिकों के आबन्ध-रेखा सूत्र लिखिए-
आइसोप्रोपिल ऐल्कोहॉल, 2, 3-डाइमेथिल ब्यूटेनल, हेप्टेन-4-ओन
उत्तर:
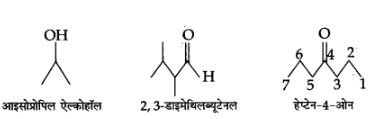
4. निम्नलिखित यौगिकों के IUPAC नाम लिखिए-
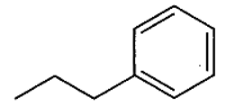
उत्तर: प्रोपिलबेन्जीन
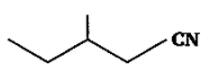
उत्तर: 3-मेथिलपेन्टेननाइट्राइल
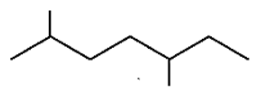
उत्तर: 2, 5-डाइमेथिलहेप्टेन
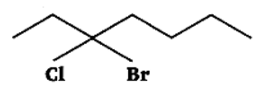
उत्तर: 3-ब्रोमो-3-क्लोरोहेप्टेन
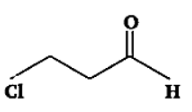
उत्तर: 3-क्लोरोप्रोपेनल
(च) $\mathrm{Cl}_{2} \mathrm{CHCH}_{2} \mathrm{OH}$
उत्तर: 2, 2-डाइक्लोरोएथेनॉल
5.निम्नलिखित यौगिकों में से कौन-सा नाम IUPAC पद्धति के अनुसार सही है?
(क) 2, 2-डाइएथिलपेन्टेन अथवा 2-डाइमेथिलपेन्टेन
(ख) 2, 4, 7-ट्राइमेथिलऑक्टेन अथवा 2, 5, 7-ट्राइमेथिलऑक्टेन
(ग) 2-क्लोरो-4-मेथिलपेन्टेन अथवा 4-क्लोरो-2-मेथिलपेन्टेन
(घ) ब्यूट-3-आइन-1-ऑल अथवा ब्यूट-4-ऑल-1-आइन
उत्तर:
(क) 2, 2-डाइमेथिलषन्टेन,
(ख) 2, 4, 7-ट्राइमेथिलऑक्टेन
(ग) 2-क्लोरो-4-मेथिलपेन्टेन,
(घ) ब्यूट-3-आइन-1-ऑल
6. निम्नलिखित दो सजातीय श्रेणियों में से प्रत्येक के प्रथम पाँच सजातों के संरचना-सूत्र लिखिए-
(क) $\mathrm{HCOOH}$
उत्तर:
$\mathrm{HCOOH}$
$\mathrm{CH}_{3} \mathrm{COOH}$
$\mathrm{CH}_{3}-\mathrm{CH}_{2}-\mathrm{COOH}$
$\mathrm{CH}_{3}-\mathrm{CH}_{2}-\mathrm{CH}_{2}-\mathrm{COOH}$
$\mathrm{CH}_{3}-\mathrm{CH}_{2}-\mathrm{CH}_{2}-\mathrm{CH}_{2}-\mathrm{COOH}$
(ख) $\mathrm{CH}_3\mathrm{COCH}_3$
उत्तर:
$\mathrm{CH}_{3} \mathrm{COOCH}_{3}$
$\mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{COOCH}_{3}$
$\mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{COOCH} \mathrm{CH}_{3}$
$\mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{COOCHCH}_{3}$
$\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{COOCH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{3}$
(ग) $\mathrm{H}-\mathrm{CH}=\mathrm{CH}_2$
उत्तर:
$\mathrm{CH}_{2}=\mathrm{CH}_{2}$
$\mathrm{CH}_{2} \mathrm{CH}=\mathrm{CH}_{2}$
$\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{CH}=\mathrm{CH}_{2}$
$\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}=\mathrm{CH}_{2}$
$\mathrm{CH}_{2} \mathrm{CH}=\mathrm{CHCH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{3}$
7. निम्नलिखित के संघनितं और आबन्ध रेखा-सूत्र लिखिए तथा यदि कोई क्रियात्मक समूह हो तो उसे पहचानिए-:
(क) 2, 2, 4-टाइमेथिल पेन्टेन
उत्तर:
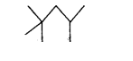
(ख) 2-हाइड्रॉक्सी-1, 2, 3-प्रोषेनट्राइकार्बोक्सिलिक अम्ल
उत्तर:
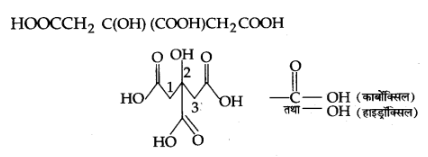
(ग) हेक्सेनडाइएल
उत्तर:
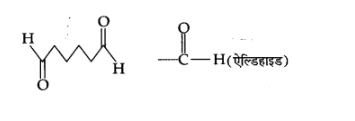
8. निम्नलिखित यौगिकों में क्रियात्मक समूह पहचानिए-
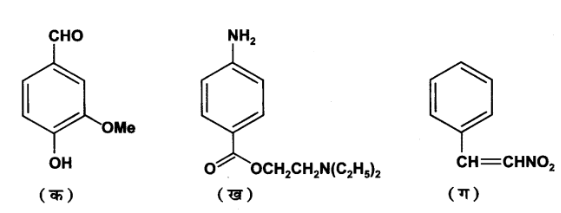
उत्तर:
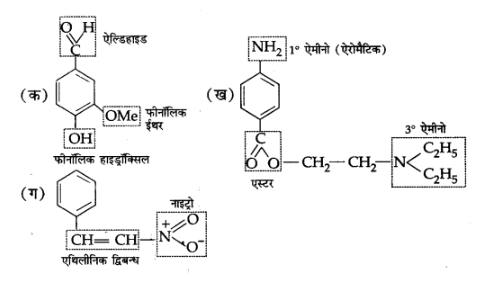
9.निम्नलिखित में से कौन अधिक स्थायी है तथा क्यों?
$\mathrm{O}_{2} \mathrm{NCH}_{2} \mathrm{CH}_{2} \mathrm{O}-$
$\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{O}-$
उत्तर: $\mathrm{CH}_{3}-\mathrm{CH}_{2} \mathrm{O}^{-}$ की तुलना में $\mathrm{O}_{2} \mathrm{~N}-\mathrm{CH}_{2}$
$\mathrm{CH}_{2} \mathrm{O}^{-}$अधिक स्थायी होता है क्योंकि $-\mathrm{NO}_{2}$ समूह - । प्रभाव प्रदर्शित करता है। जिसके कारण ऋणावेश विरल होता है। दूसरी ओर - $\mathrm{CH}_{3}$ समूह +। प्रभाव प्रदर्शित करता है, जिसके कारण ऋणावेश सघन हो जाता है। आवेश के विरल हो जाने के कारण आयन का स्थायित्व बढ़ता है जबकि, ऋणावेश के सघन हो जाने के कारण आयन का स्थायित्व घटता है।
10. निकाय से आबन्धित होने पर ऐल्किल समूह इलेक्ट्रॉनदाता की तरह व्यवहार प्रदर्शित क्यों करते हैं? समझाइए।
उत्तर: अतिसंयुग्मन के कारण -निकाय से आबन्धित होने पर ऐल्किल समूह इलेक्ट्रॉन दाता की तरह कार्य करते हैं जैसा कि नीचे प्रदर्शित है-
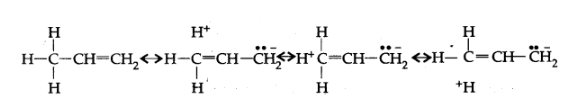
11. निम्नलिखित यौगिकों की अनुनाद संरचना लिखिए तथा इलेक्ट्रॉनों का विस्थापन मुड़े तीरों की सहायता से दर्शाइए-
(क) $\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{OH}$
उत्तर:
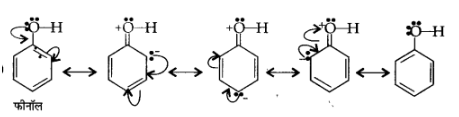
(ख) $\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NO}_{2}$
उत्तर:
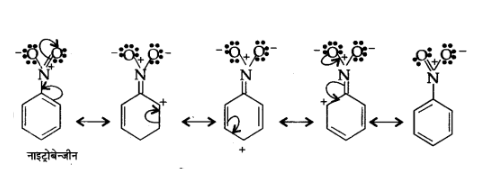
(ग) $\mathrm{CH}_{3} \mathrm{CH}=\mathrm{CHCHO}$
उत्तर:
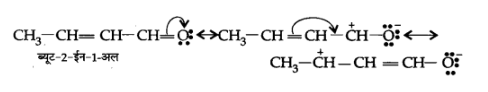
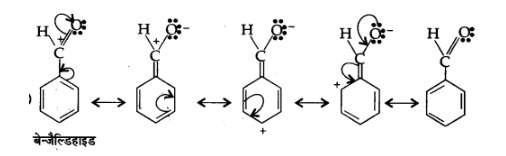
(घ) $\mathrm{C}_{6} \mathrm{H}_{5}-\mathrm{CHO}$
उत्तर:
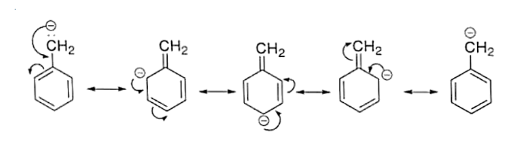
(ङ) $\mathrm{C}_{6} \mathrm{H}_{5}-\mathrm{CH}^{+}{ }_{2}$
उत्तर:
(च) $\mathrm{CH}_{3} \mathrm{CH}=\mathrm{CHCH}_{2}$
उत्तर:
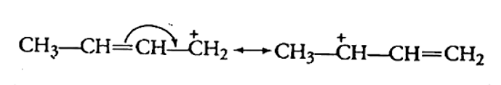
12. इलेक्ट्रॉनस्नेहीं तथा नाभिकस्नेही क्या हैं? उदाहरण सहित समझाइए।
उत्तर: नाभिकस्नेही और इलेक्ट्रॉनस्नेही इलेक्ट्रॉन-युग्म प्रदान करने वाला अभिकर्मक ‘नाभिकस्नेही’ अर्थात् ‘नाभिक खोजने वाला’ कहलाता है तथा अभिक्रिया ‘नाभिकस्नेही अभिक्रिया’ कहलाती है। इलेक्ट्रॉन युग्म ग्रहण करने वाले अभिकर्मक को इलेक्ट्रॉनस्नेही अर्थात् ‘इलेक्ट्रॉन चाहने वाला कहते हैं और अभिक्रिया ‘इलेक्ट्रॉनस्नेही अभिक्रिया’ कहलाती है।
ध्रुवीय कार्बनिक अभिक्रियाओं में क्रियाधारक के इलेक्ट्रॉनस्नेही केन्द्र पर नाभिकस्नेही आक्रमण करता है। यह क्रियाधारक का विशिष्ट परमाणु अथवा इलेक्ट्रॉन न्यून भाग होता है। इसी प्रकार क्रियाधारकों के इलेक्ट्रॉनधनी नाभिकस्नेही केन्द्र पर इलेक्ट्रॉनस्नेही आक्रमण करता है। अतः आबन्धन अन्योन्यक्रिया के फलस्वरूप इलेक्ट्रॉनस्नेही से इलेक्ट्रॉन-युग्म प्राप्त करता है। नाभिकस्नेही से इलेक्ट्रॉनस्नेही की ओर इलेक्ट्रॉनों का संचलन वक्र तीर द्वारा प्रदर्शित किया जाता है। नाभिकस्नेही के उदाहरणों में हाइड्रॉक्साइड (OH–), सायनाइड आयन (CN– ) तथा कार्बऋणायन
(image will be uploaded soon) कुछ आयन सम्मिलित हैं। इसके अतिरिक्त कुछ उदासीन अणु, (जैसे (image will be uploaded soon)आदि) भी एकाकी इलेक्ट्रॉन-युग्म की उपस्थिति के कारण नाभिकस्नेही की भाँति कार्य करते हैं। इलेक्ट्रॉनस्नेही के उदाहरणों में कार्बधनायन (image will be uploaded soon)और कार्बोनिल समूह
(image will be uploaded soon) अथवा ऐल्किल हैलाइड ($R_3C—X$, X= हैलोजेन परमाणु) वाले। उदासीन अणु सम्मिलित हैं। कार्बधनायन का कार्बन केवल षष्टक होने के कारण इलेक्ट्रॉन-न्यून होता है तथा नाभिकस्नेही से इलेक्ट्रॉन-युग्म ग्रहण कर सकता है। ऐल्किल हैलाइड का कार्बन आबन्ध ध्रुवता के कारण इलेक्ट्रॉनस्नेही–केन्द्र बन जाता है जिस पर नाभिकस्नेही आक्रमण कर सकता है।
13.निम्नलिखित समीकरणों में रेखांकित अभिकर्मकों को नाभिकस्नेही तथा इलेक्ट्रॉनस्नेही में वर्गीकृत कीजिए-
(क) $\mathrm{CH}_{3} \mathrm{COOH}+{\mathrm{HO}} \longrightarrow \mathrm{CH}_{3} \mathrm{COO}^{-}+\mathrm{H}_{2} \mathrm{O}$
उत्तर: नाभिकस्नेही
(ख) $\mathrm{CH}_{3} \mathrm{COCH}_{3}+{\mathrm{CN}} \longrightarrow\left(\mathrm{CH}_{3}\right)_{2} \mathrm{C}(\mathrm{CN})(\mathrm{OH})$
उत्तर: नाभिकस्नेही
(ग) $\mathrm{C}_{6} \mathrm{H}_{6}+{\mathrm{CH}_{3} \mathrm{C O}}^{+}{\mathrm{CO}} \longrightarrow \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{COCH}_{3}$
उत्तर: इलेक्ट्रॉनस्नेही
14. निम्नलिखित अभिक्रियाओं को वर्गीकृत कीजिए-
$\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{Br}+\mathrm{HS}^{-}-\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{SH}+\mathrm{Br}^{-}$
उत्तर: नाभिकस्नेही प्रतिस्थापन
$\left.\left(\mathrm{CH}_{3}\right)_{2} \mathrm{C}=\mathrm{CH}_{2}+\mathrm{HCl}-\cdots-\ldots-\mathrm{CH}_{3}\right)_{2} \mathrm{C}(\mathrm{CN})(\mathrm{OH})$
उत्तर: इलेक्ट्रॉनस्नेही योगात्मक
$\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{Br}+\mathrm{OH}^{-}--\ldots-\cdots-\mathrm{CH}_{2}=\mathrm{CH}_{2}+\mathrm{H}_{2} \mathrm{O}+\mathrm{Br}^{-}$
उत्तर: विलोपन
$\left.\left(\mathrm{CH}_{3}\right)_{3} \mathrm{C}-\mathrm{CH}_{2} \mathrm{OH}+\mathrm{HBr}-\cdots-\mathrm{CH}_{3}\right)_{2} \mathrm{CBrCH}_{2} \mathrm{CH}_{2}+$ $\mathrm{H}_{2} \mathrm{O}$
उत्तर: पुनर्विन्यास युक्त नाभिकस्नेही प्रतिस्थापन
15. निम्नलिखित युग्मों में सदस्य-संरके मध्य कैसा सम्बन्ध है? क्या ये संरचनाएँ संरचनात्मक या ज्यामितीसमवयव अथवा अनुनाद संरचनाएँ हैं।
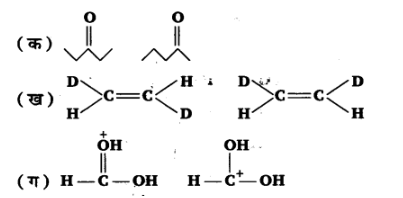
उत्तर:
(क) स्थिति समावयवी और मध्यावयवी
(ख) ज्यामितीय समावयवी,
(ग) अनुनाद संरचनाएँ।
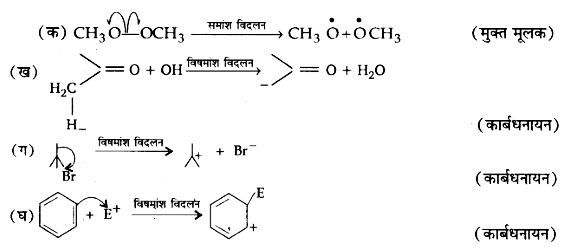
16. निम्नलिखित आबन्ध विदलनों के लिए इलेक्ट्रॉन विस्थापन को मुड़े तीरों द्वारा दर्शाइए तथा प्रत्येक विदलन को समांश अथवा विषमांश में वर्गीकृत कीजिए। साथ ही निर्मित सक्रिय मध्यवर्ती उत्पादों में मुक्त-मूलक, कार्बधनायन तथा कार्बऋणायन पहचानिए-
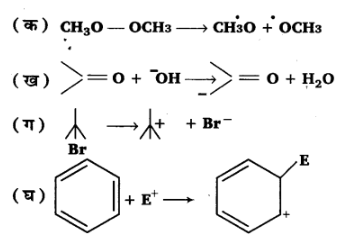
उत्तर:
17. प्रेरणिक तथा इलेक्ट्रोमेरी प्रभावों की व्याख्या कीजिए। निम्नलिखित कार्बोक्सिलिक अम्लों की अम्लता का सही क्रम कौन-सा इलेक्ट्रॉन-विस्थापन वर्णित करता है?
(क) $\mathrm{Cl}_{3} \mathrm{CCOOH}>\mathrm{Cl}_{2} \mathrm{CHCOOH}>\mathrm{ClCH}_{2} \mathrm{COOH}$
(ख) $\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{COOH}>\left(\mathrm{CH}_{3}\right)_{2} \mathrm{CHCOOH}>\left(\mathrm{CH}_{3}\right)_{3} \mathrm{C} . \mathrm{COOH}$
उत्तर: प्रेरणिक प्रभाव भिन्न विद्युत-ऋणात्मकता के दो परमाणुओं के मध्य निर्मित सहसंयोजक आबन्ध में इलेक्ट्रॉन असमान रूप से सहभाजित होते हैं। इलेक्ट्रॉन घनत्व उच्च विद्युत ऋणात्मकता के परमाणु के ओर अधिक होता है। इस कारण सहसंयोजक आबन्ध ध्रुवीय हो जाता है। आबन्ध ध्रुवता के कारण कार्बनिक अणुओं में विभिन्न इलेक्ट्रॉनिक प्रभाव उत्पन्न होते हैं।
उदाहरणार्थ-क्लोरोएथेन $\left(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{Cl}\right)$ में $\mathrm{C}-\mathrm{Cl}$ में C—Cl बन्ध ध्रुवीय है। इसकी ध्रुवता के कारण कार्बन क्रमांक-1 पर आंशिक धनावेश (δ+) तथा क्लोरीन पर आंशिक ऋणावेश (δ–) उत्पन्न हो जाता है। आंशिक आवेशों को दर्शाने के लिए δ (डेल्टा) चिह्न प्रयुक्त करते है। आबन्ध में इलेक्ट्रॉन-विस्थापन दर्शाने के लिए तीर (→) का उपयोग किया जाता है, जो 8′ से 6 की ओर आमुख होता है।
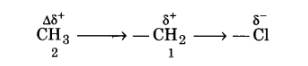
कार्बन-1 अपने आंशिक धनावेश के कारण पास के C—C आबन्ध के इलेक्ट्रॉनों को अपनी ओर आकर्षित करने लगता है। फलस्वरूप कार्बन-2 पर भी कुछ धनावेश (∆δ+) उत्पन्न हो जाता है। C—1 पर स्थित धनावेश की तुलना में ∆δ+ अपेक्षाकृत कम धनावेश दर्शाता है। दूसरे शब्दों में, C—CI की ध्रुवता के कारण पास के आबन्ध में ध्रुवता उत्पन्न हो जाती है। समीप के ठ-आबन्ध के कारण अगले 6-आबन्ध के ध्रुवीय होने की प्रक्रिया प्रेरणिक प्रभाव कहलाती है। यह प्रभाव आगे के आबन्धों तक भी जाता है, लेकिन आबन्धों की संख्या बढ़ने के साथ-साथ यह प्रभाव कम होता जाता है और तीन आबन्धों के बाद लगभग लुप्त हो जाता है। प्रेरणिक प्रभाव का सम्बन्ध प्रतिस्थापी से बन्धित कार्बन परमाणु को इलेक्ट्रॉन प्रदान करने अथवा अपनी ओर आकर्षित कर लेने की योग्यता से है। इस योग्यता के आधार पर प्रतिस्थापियों को हाइड्रोजन के सापेक्ष इलेक्ट्रॉन-आकर्षी या इलेक्ट्रॉनदाता समूह के रूप में वर्गीकृत किया जाता है। हैलोजन तथा कुछ अन्य समूह; जैसे-नाइट्रो (—$NO_2$), सायनो (—CN), कार्बोक्सी (—COOH), एस्टर (—COOR), ऐरिलॉक्सी (—OAr ) इलेक्ट्रॉन आकर्षी समूह हैं; जबकि ऐल्किल समूह; जैसे—मेथिल (—$CH_3$), एथिल (—$CH_2—CH_3$) आदि इलेक्ट्रॉनदाता समूह हैं।
इलेक्ट्रोमेरी प्रभाव (E प्रभाव) यह एक अस्थायी प्रभाव है। केवल आक्रमणकारी अभिकारकों की उपस्थिति में यह प्रभाव बहुआबन्ध (द्विआबन्ध अथवा त्रिआबन्ध) वाले कार्बनिक यौगिकों में प्रदर्शित होता है। इस प्रभाव में आक्रमण करने वाले अभिकारके की माँग के कारण बहु-आबन्ध से बन्धित परमाणुओं में एक सहभाजित -इलेक्ट्रॉन युग्म का पूर्ण विस्थापन होता है। अभिक्रिया की परिधि से आक्रमणकारी अभिकारक को हटाते ही यह प्रभाव शून्य हो। जाता है। इसे E द्वारा दर्शाया जाता है, जबकि इलेक्ट्रॉन के संचलन को वक्र तीर (↷)द्वारा प्रदर्शित किया जाता है। स्पष्टतः दो प्रकार के इलेक्ट्रोमेरी प्रभाव होते हैं-
धनात्मक इलेक्ट्रोमेरी प्रभाव (+E प्रभाव)- इस प्रभाव में बहुआबन्ध के ए-इलेक्ट्रॉनों का स्थानान्तरण उस परमाणु पर होता है जिससे आक्रमणकारी अभिकर्मक बन्धित होता है।
उदाहरणार्थ-
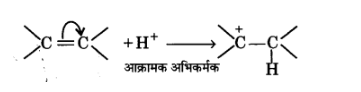
ऋणात्मक इलेक्ट्रोमेरी प्रभाव(-E प्रभाव)— इस प्रभाव में बहु-आबन्ध के -इलेक्ट्रॉनों का स्थानान्तरण उस परमाणु पर होता है जिससे आक्रमणकारी अभिकर्मक बन्धित नहीं होता है। इसका
उदाहरण निम्नलिखित है-

जब प्रेरणिक तथा इलेक्ट्रोमेरी प्रभाव एक-दूसरे की विपरीत दिशाओं में कार्य करते हैं, तब इलेक्ट्रोमेरिक प्रभाव प्रबल होता है।
(क) $\mathrm{Cl}_{3} \mathrm{CCOOH}>\mathrm{Cl}_{2}\mathrm{CHCOOH}>\mathrm{ClCH}_{2} \mathrm{COOH}$
यह इलेक्ट्रॉन आकर्षी प्रेरणिक प्रभाव (-I) दर्शाता है।
(ख) $\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{COOH}>\left(\mathrm{CH}_{3}\right)_{2} \mathrm{CHCOOH}>\left(\mathrm{CH}_{3}\right)_{3} \mathrm{C} . \mathrm{COOH}$
यह इलेक्ट्रॉन दाता प्रेरणिक प्रभाव (+I) दर्शाता है।
18.प्रत्येक का एक उदाहरण देते हुए निम्नलिखित प्रक्रमों के सिद्धान्तों का संक्षिप्त विवरण दीजिए
(क) क्रिस्टलन,
(ख) आसवन,
(ग) क्रोमैटोग्रैफी।
उत्तर:
(क) क्रिस्टलन - यह ठोस कार्बनिक पदार्थों के शोधन की प्रायः प्रयुक्त विधि है। यह विधि कार्बनिक यौगिक तथा अशुद्धि की किसी उपयुक्त विलायक में इनकी विलेयताओं में निहित अन्तर पर आधारित होती है। अशुद्ध यौगिक को किसी ऐसे विलायक में घोलते हैं जिसमें यौगिक सामान्य ताप पर अल्प-विलेय होता है, परन्तु उच्चतर ताप परे यथेष्ट मात्रा में वह घुल जाता है। तत्पश्चात् विलयन को इतना सान्द्रित करते हैं कि वह लगभग संतृप्त हो जाए। विलयन को ठण्डा करने पर शुद्ध पदार्थ क्रिस्टलित हो जाता है जिसे निस्यन्दन द्वारा पृथक् कर लेते हैं। निस्यन्द (मातृ द्रव) में मुख्य रूप से अशुद्धियाँ तथा यौगिक की अल्प मात्रा रह जाती है। यदि यौगिक किसी एक विलायक में अत्यधिक विलेय तथा किसी अन्य विलायक में अल्प विलेय होता है, तब क्रिस्टलन उचित मात्रा में इन विलायकों को मिश्रित करके किया जाता है। सक्रियिंत काष्ठ कोयले' की सहायता से रंगीन अशुद्धियाँ निकाली जाती हैं। यौगिक तथा अशुद्धियों की विलेयताओं में कम अन्तर होने की दशा में बार-बार क्रिस्टलन द्वारा शुद्ध यौगिक प्राप्त किया जाता है।
(ख) आसवन —इस महत्त्वपूर्ण विधि की सहायता से (i) वाष्पशील द्रवों को अवाष्पशील अशुद्धियों से एवं (ii) ऐसे द्रवों को, जिनके क्वथनांकों में पर्याप्त अन्तर हो, पृथक् कर सकते हैं। भिन्न क्वथनांकों वाले द्रव भिन्न ताप पर वाष्पित होते हैं। वाष्पों को ठण्डा करने से प्राप्त द्रवों को अलग-अलग एकत्र कर लेते हैं। क्लोरोफॉर्म (क्वथनांक 334K) और ऐनिलीन (क्वथनांक 457 K) को आसवन विधि द्वारा आसानी से पृथक् कर सकते हैं। द्रव-मिश्रण को गोल पेंदे वाले फ्लास्क में लेकर हम सावधानीपूर्वक गर्म करते हैं। उबालने पर कम क्वथनांक वाले द्रव की वाष्प पहले बनती है। वाष्प को संघनित्र की सहायता से संघनित करके प्राप्त द्रव को ग्राही में एकत्र कर लेते हैं। उच्च क्वथनांक वाले घटक के वाष्प बाद में बनते हैं। इनमें संघनन से प्राप्त द्रव को दूसरे ग्राही में एकत्र कर लेते हैं।
(ग) वर्णलेखन -‘वर्णलेखन (क्रोमैटोग्रफी) शोधन की एक अत्यन्त महत्त्वपूर्ण तकनीक है जिसका उपयोग यौगिकों का शोधन करने में, किसी मिश्रण के अवयवों को पृथक् करने तथा यौगिकों की शुद्धता की जाँच करने के लिए विस्तृत रूप से किया जाता है। क्रोमैटोग्रफी विधि का उपयोग सर्वप्रथम पादपों में पाए जाने वाले रंगीन पदार्थों को पृथक् करने के लिए किया गया था। ‘क्रोमैटोग्रैफी’ शब्द ग्रीक शब्द क्रोमा’ से बना है जिसका अर्थ है ‘रंग’। इस तकनीक में सर्वप्रथम यौगिकों के मिश्रण को स्थिर प्रावस्था पर अधिशोषित कर दिया जाता है। स्थिर प्रावस्था ठोस अथवा द्रव हो सकती है। इसके पश्चात् स्थिर प्रावस्था में से उपयुक्त विलायक, विलायकों के मिश्रणं अथवा गैस को धीरे-धीरे प्रवाहित किया जाता है। इस प्रकार मिश्रण के अवयव क्रमशः एक-दूसरे से पृथक् हो जाते हैं। गति करने वाली प्रावस्था को ‘गतिशील प्रावस्था कहते हैं। अन्तर्ग्रस्त सिद्धान्तों के आधार पर वर्णलेखन को विभिन्न वर्गों में वर्गीकृत किया गया है। इनमें से दो हैं-
अधिशोषण- (वर्णलेखन)- यह इस सिद्धान्त पर आधारित है कि किसी विशिष्ट अधिशोषक’ (adsorbent) पर विभिन्न यौगिक भिन्न अंशों में अधिशोषित होते हैं। साधारणतः ऐलुमिना तथा सिलिका जेल अधिशोषक के रूप में प्रयुक्त किए जाते हैं। स्थिर प्रावस्था (अधिशोषक) पर गतिशील प्रावस्था प्रवाहित करने के उपरान्त मिश्रण के अवयव स्थिर प्रावस्था पर अलग-अलग दूरी तय करते हैं। निम्नलिखित दो प्रकार की वर्णलेखन-तकनीकें हैं, जो विभेदी-अधिशोषण सिद्धान्त पर आधारित हैं-
कॉलम-वर्णलेखन अर्थात् स्तम्भ-वर्णलेखन
पतली पर्त वर्णलेखन
वितरण क्रोमैटोग्रैफी –वितरण क्रोमैटोग्रॅफी स्थिर तथा गतिशील प्रावस्थाओं के मध्य मिश्रण के अवयवों के सतत् विभेदी वितरण पर आधारित है। कागज वर्णलेखनnइसका एक उदाहरण है। इसमें एक विशिष्ट प्रकार के क्रोमैटोग्रॅफी कागज का इस्तेमाल किया जाता है। इस कागज के छिद्रों में जल-अणु पाशित रहते हैं, जो स्थिर प्रावस्था का कार्य करते हैं।
19. ऐसे दो यौगिकों, जिनकी विलेयताएँ विलायक s, में भिन्न हैं, को पृथक करने की विधि की व्याख्या कीजिए।
उत्तर:
ऐसे दो यौगिकों, जिनकी विलेयताएँ विलायक s, में भिन्न हैं, को पृथक् करने के लिए। क्रिस्टलन विधि प्रयोग की जाती है। इस विधि में अशुद्ध यौगिक को किसी ऐसे विलायक में घोलते हैं। जिसमें यौगिक सामान्य ताप पर अल्प-विलेय तथा उच्च ताप पर विलेय होता है। इसके पश्चात् विलयन को सान्द्रित करते हैं जिससे वह लगभग संतृप्त हो जाए। अब अल्प-विलेय घटक पहले क्रिस्टलीकृत हो जाएगा तथा अधिक विलेय घटक पुनः गर्म करके ठण्डा करने पर क्रिस्टलीकृत होगा। इसके अतिरिक्त सक्रियित काष्ठ कोयले की सहायता से रंगीन अशुद्धियाँ निकाल दी जाती हैं। यौगिक तथा अशुद्धि की विलेयताओं में कम अन्तर होने पर बार-बार क्रिस्टलन करने पर शुद्ध यौगिक प्राप्त किया जाता है।
20. आसवन, निम्न दाब पर आसवन तथा भाप आसवन में क्या अन्तर है? विवेचना कीजिए।
उत्तर: आसवन का तात्पर्य द्रव का वाष्प में परिवर्तन तथा वाष्प का संघनित होकर शुद्ध द्रव देना है। इस विधि का प्रयोग उन द्रवों के शोधन में किया जाता है जो बिना अपघटित हुए उबलते हैं तथा जिनमें अवाष्पशील अशुद्धियाँ होती हैं।
निम्न दाब पर आसवन में भी गर्म करने पर द्रव वाष्प में परिवर्तित होता है तथा संघनित होकर शुद्ध द्रव देता है परन्तु यहाँ निकाये पर कार्यरत् दाब वायुमण्डलीय दाब नहीं होता है; उसे निर्वात् पम्प की सहायता से घटा दिया जाता है। दाब घटाने पर द्रव का क्वथनांक घट जाता है। अतः इस विधि का प्रयोग उन द्रवों के शोधन में किया जाता है जिनके क्वथनांक उच्च होते हैं या वे अपने क्वथनांक से नीचे अपघटित हो जाते हैं।
भाप आसवन कम दाब पर आसवन के समान होता है लेकिन इसमें कुल दाब में कोई कमी नहीं आती है। इसमें कार्बनिक द्रव तथा जल उस ताप पर उबलते हैं जब कार्बनिक द्रव का वाष्प दाब (p1) तथा जल का वाष्प दाब (p2) वायुमण्डलीय दाब (p) के बराबर हो जाते हैं।
p= p1 + p-कक्षकों
इस स्थिति में कार्बनिक द्रव अपने सामान्य क्वथनांक से कम ताप पर उबलता है जिससे उसका अपघटन नहीं होता है।
21. लैंसे-परीक्षण का रसायन-सिद्धान्त समझाइए।
उत्तर: किसी कार्बनिक यौगिक में शुपस्थित नाइट्रोजन, सल्फर, हैलोजेन तथा फॉस्फोरस की पहचान ‘लैंसे-परीक्षण’ द्वारा की जाती है। यौगिक को सोडियम धातु के साथ संगलित करने पर ये तत्व सहसंयोजी रूप से आयनिक रूप में परिवर्तित हो जाते हैं। इनमें निम्नलिखित अभिक्रियाएँ होती हैं-
$\mathrm{Na}+\mathrm{C}+\mathrm{N} \stackrel{\Delta}{\longrightarrow} \mathrm{NaCN}$
$2 \mathrm{Na}+\mathrm{S} \stackrel{\Delta}{\longrightarrow} \mathrm{Na}_{2} \mathrm{~S}$
$\mathrm{Na}+\mathrm{C}+\mathrm{N}+\mathrm{S} \longrightarrow \mathrm{NaSCN}$
$\mathrm{Na}+\mathrm{X} \stackrel{\Delta}{\longrightarrow} \mathrm{NaX}$
$(\mathrm{X}=\mathrm{Cl}, \mathrm{Br}, \mathrm{I})$
C, N, S तथा X कार्बनिक यौगिक में उपस्थित तत्व हैं। सोडियम संगलन से प्राप्त अवशेष को आसुत जल के साथ उबालने पर सोडियम सायनाइड, सल्फाइड तथा हैलाइड जल में घुल जाते हैं। इस निष्कर्ष को ‘सोडियम संगलन निष्कर्ष’ कहते हैं।
22. किसी कार्बनिक यौगिक में नाइट्रोजन के आकलन की (i) ड्यूमा विधि तथा (ii) जेलदाहलविधि के सिद्धान्त की रूपरेखा प्रस्तुत कीजिए।
उत्तर: नाइट्रोजन के परिमाणात्मक निर्धारण की निम्नलिखित दो विधियाँ प्रयुक्त की जाती हैं-
ड्यूमा विधि - नाइट्रोजनयुक्त कार्बनिक यौगिक क्यूप्रिक ऑक्साइड के साथं गर्म करने पर इसमें उपस्थित कार्बने हाइड्रोजन गन्धिक तथा नाइट्रोजन क्रमशः $\mathrm{CO}_{2}^{\prime} \mathrm{H}_{2} \mathrm{O}_{3} \mathrm{SO}_{2}$$\mathrm{N}_{2S}\mathrm{O}$ के रूप्प में ऑक्सीकृत हो जाते हैं। इस गैसीय मिश्रण की रक्त तप्त कॉंपर की जाली के ऊपर प्रवाहित करने पर नाइट्रोजन के ऑक्साइडों का नाइट्रोजन में अपचयन हो जाता है।
$4 \mathrm{Cu}+2 \mathrm{NO}_{2} \rightarrow 4 \mathrm{CuO}+\mathrm{N}_{2} \uparrow$
$2 \mathrm{Cu}+2 \mathrm{NO} \rightarrow 2 \mathrm{CuO}+\mathrm{N}_{2} \uparrow$
$\mathrm{Cu}+\mathrm{N}_{2} \mathrm{O} \rightarrow \mathrm{CuO}+\mathrm{N}_{2} \uparrow$
इस प्रकार $\mathrm{N}_{2}, \mathrm{CO}_{2}, \mathrm{H}_{2} \mathrm{O}$ तथा $\mathrm{SO}_{2}$ युक्त गैसीय मिश्रण को $\mathrm{KOH}$ से भरी नाइट्रोमीटर नामक अंशांकित नली में प्रवाहित करने पर $\mathrm{CO}_{2}, \mathrm{H}_{2} \mathrm{O}$ तथा $\mathrm{SO}_{2}$ का KOH द्वारा अवशोषण हो जाता है और बची हुई $\mathrm{N}_{2}$ गैस को नाइटोमीटर में जल के ऊपर एकत्र कर लिया जाता है। इस नाइट्रोजन का आयतन वायुमण्डल के दाब तथा ताप पर नोट कर लेते हैं। फिर इस आयतन को गैस समीकरण की सहायता से सामान्य ताप व दाब (N.T.P) पर परिवर्तित कर लेते हैं।
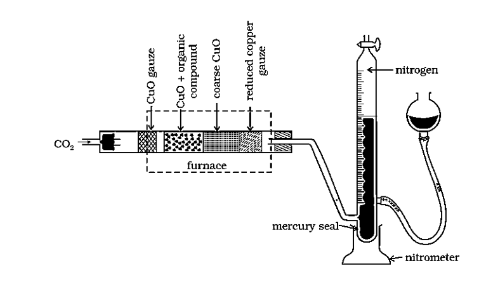
ड्यूमा विधि। कार्बनिक धौगिक को $\mathrm{CO}_{2}$ गैस की उपस्थिति में $\mathrm{Cu}(\mathrm{II})$ ऑक्साइड के साथ गर्म करने पर नाइट्रोजन गैस उत्पन्न होती है। गैसों के मिश्रण को पोटैशियम हाइड्रॉक्साइड विलयन में से प्रवाहित किया जाता है, जहाँ $\mathrm{CO}_{2}$ अवशोषित हो जाती है तथा नाइट्रोजन का आयतन माप लिया जाता है।
मान लिया, $m$ ग्राम कार्बनिक यौगिक से N.T.P. पर $x$ मिली नाइट्रोजन प्राप्त होती है।
$\because$ N.T.P. पर 22,400 मिली नाइट्रोजन $\left(\mathrm{N}_{2}\right)$ की मात्रा $=28$ ग्राम $\left(\mathrm{N}_{2}\right.$ का ग्राम अणुभार $)$
$\therefore \quad$ N.T.P. पर $x$ मिली नाइट्रोजन $\left(\mathrm{N}_{2}\right)$ की मात्रा $=\frac{28 x}{22,400}$ ग्राम
$\because m$ ग्राम कार्बनिक यौगिक में नाइट्रोजन $\left(\mathrm{N}_{2}\right)$ की मात्रा $=\frac{28 x}{22,400}$ ग्राम
$\therefore 100$ ग्राम कार्बनिक यौगिक में नाइट्रोजन $\left(\mathrm{N}_{2}\right)$ की मात्रा $=\frac{28 x \times 100}{22,400 \times m}$ ग्राम
नाइट्रोजन की प्रतिशत मात्रा $(\%)=\frac{28}{22,400} \times \frac{\mathrm{N}_{2} \text { का N. T.P. पर आयतन }}{\text { कार्बनिक यौगिक का भार }} \times 100$
$=\frac{1}{8} \times \frac{\mathrm{N}_{2} \text { का N. T. P. पर आयतन }}{\text { कार्बनिक यौगिक का भार }}$
जेलदाहलविधि - यह विधि इस सिद्धान्त पर आधारित है कि जब किसी नाइट्रोजनयुक्त कार्बन यौगिक को पोटेशियम सल्फेट की उपस्थिति में सान्द्र $\mathrm{H}_{2} \mathrm{SO}_{4}$ के साथ गर्म करते हैं तो उसर्में उपस्थित नाइट्रोजन पूर्णरूप से अमोनियम सल्फेट में परिवर्तित हो जाती है। इस प्रकार प्राप्त अमोनियम सल्फेट को साद्र कॉस्टिक सोडा विलयन के साथ गर्म करने पर अमोनिया गैस निकलती है जिसको ज्ञात सान्द्रण वाले $\mathrm{H}_{2} \mathrm{SO}_{4}$ के निश्चित आयतन में अवशोषित कर लेते हैं। इस अम्ल का मानक $\mathrm{NaOH}$ के साथ अनुमापन करके गणना द्वारा अवशोषित हुई अमोनिया की मात्रा ज्ञात की जाती है। फिर नाइट्रोजन के आयतन की गणना कर ली जाती है।
$(NH_4)_2 SO_4+2 NaOH \rightarrow Na_2SO_4+2 H_2 O+2 NH_3$
$2 NH_3+H_2 SO_4 \rightarrow (NH_4)_2 SO_4$
मान लिया, कार्बनिक यौगिक की भार $=\mathrm{m}$
प्रयुक्त अम्ल का आयतन $=y$ मिली
प्रयुक्त अम्ल की नॉर्मलता $=\mathrm{N}$
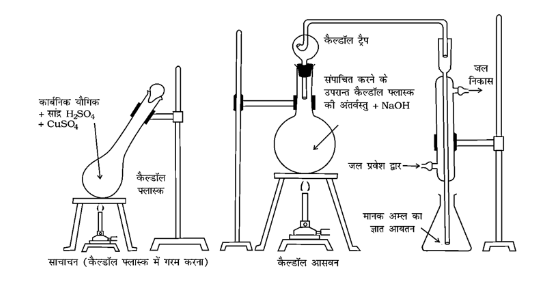
जेलदाहल विधि-नाइट्रोजनयुक्त यौगिक को सांद्र सल्फ्यूरिक अम्ल के साथ गरम करने पर अमोनियम सल्फेट बनता है, जो $\mathrm{NaOH}$ द्वारा अभिकृत करने पर अमोनिया मुक्त करता है। इसे मानक अम्ल के ज्ञात आयतन में अवशोषित किया जाता है।
$V$ मिली $N$ नॉर्मलता का अम्ल $\equiv V$ मिली $N$ नॉर्मलता की अमोनिया
1000 मिली $N$ नॉर्मलता वाली अमोनिया में, 17 ग्राम अमोनिया या 14 ग्राम नाइट्रोजन होती है।
$V$ मिली $N-\mathrm{NH}_{3}$ में नाइट्रोजन की मात्रा $=\frac{14}{1000} \times V \times N=0.014 \mathrm{NV}$ ग्राम
$\because m$ ग्राम कार्बनिक यौगिक में नाइट्रोजन की मात्रा $=0.014 \mathrm{NV}$ ग्राम
$\therefore 100$ ग्राम कार्बनिक यौगिक में नाइट्रोजन की मात्रा $=\frac{0 \cdot 014 N V \times 100}{m}=\frac{1 \cdot 4 N V}{m}$ ग्राम कार्बनिक यौगिक में नाइट्रोजन की प्रतिशत मात्रा
$(\%)=\frac{1 \cdot 4 \times \text { प्राप्त } \mathrm{NH}_{3} \text { की नॉर्मलता } \times \text { प्राप्त } \mathrm{NH}_{3} \text { का आयतन ( मिली में) }}{\text { कार्बनिक यौगिक का भार ( ग्राम में ) }}$
23. किसी यौगिक में हैलोजेन, सल्फर तथा फॉस्फोरस के आकलन के सिद्धान्त की विवेचना कीजिए।
उत्तर:
हैलोजेन का आकलन - कार्बंनिक यौगिक के ज्ञात भार को सधूम $\mathrm{HNO}_{3}$ तथा $\mathrm{AgNO}_{3}$ के कुछ क्रिस्टलों के साथ केरियस नली में लेते हैं। नली का ऊपरी सिरा बन्द कर दिया जाता है। केरियस नली को विद्युत भट्टी में रखकर $180^{\circ}-200^{\circ} \mathrm{C}$ पर लगभग $3-4$ घण्टे गर्म करते हैं। यौगिक में उपस्थित हैलोजेन (CI, Br, I), सिल्वर हैलाइड के अवक्षेप में बदल जाते हैं। सिल्वर हैलाइड के अवक्षेप को धोकर तथा सुखाकर तौल लेते हैं। इस प्रकार प्राप्त सिल्वर हैलाइड के भार से हैलोजेन की प्रतिशत मात्रा निम्नलिखित गणना की सहायता से ज्ञात कर लेते हैं
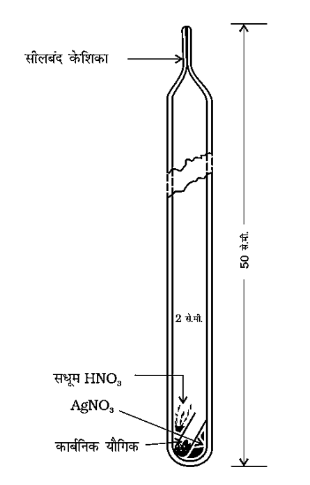
केरीयस विधि-हैलोजनयुक्त कार्बनिक यौगिक को सिल्वर नाइट्रेट की उपस्थिति में सधूम नाइट्रिक अम्ल के साथ गरम किया जाता है।
अभिक्रियाएँ-
हैलोजेनयुक्त कार्बनिक यौगिक $+\mathrm{HNO}_{3} \longrightarrow \mathrm{HX}$
$[\mathrm{X}=\mathrm{Cl}, \mathrm{Br}, \mathrm{I}]$
$\mathrm{HX}+\mathrm{AgNO}_{3} \longrightarrow \mathrm{AgX} \downarrow+\mathrm{HNO}_{3}$
मान लिया कि $m$ ग्राम पदार्थ से $x$ ग्राम $\mathrm{AgCl}$ प्राप्त होता है।
$(\mathrm{AgCl}$ का अणुभार $=108+35.5=143.5$ )
$143.5$ ग्राम $\mathrm{AgCl}$ में क्लोरीन की मात्रा $=35.5$ ग्राम
$\therefore \quad x$ ग्राम $\mathrm{AgCl}$ में क्लोरीन की मात्रा $=\frac{35.5}{143.5} \times x$ ग्राम
$\because m$ ग्राम कार्बनिक यौगिक में क्लोरीन की मात्रा $=\frac{35.5}{143.5} \times x$ ग्राम
$\therefore 100$ ग्राम कार्बनिक यौगिक में क्लोरीन की मात्रा $=\frac{35.5 \times x \times 100}{143.5 \times m}$ ग्राम
$\mathrm{Cl}$ की प्रतिशत मात्रा $(\%)=\frac{35.5}{143.5} \times \frac{\mathrm{AgBr} \text { का भार }}{\text { कार्बनिक यौगिक का भार }} \times \mathrm{i} 00$
इसी प्रकार,
$\mathrm{Br}$ की प्रतिशत मात्रा $(\%)=\frac{80}{188} \times \frac{\mathrm{AgBr} \text { का भार }}{\text { कार्बनिक यौगिक का भार }} \times 100$ की प्रतिशत मात्रा $(\%)=\frac{127}{235} \times \frac{A g I \text { का भार }}{\text { कार्बनिक यौगिक का भार }} \times 100$
सल्फर का आकलन-
इस सिद्धान्त के अनुसार, सल्फरयुक्त कार्बनिक यौगिक को सान्द्र नाइट्रिक अम्ल के साथ गर्म करने पर यौगिक में उपस्थित समस्त गन्धक, सल्फ्यूरिक अम्ल में ऑक्सीकृत हो जाती है। इसमें $BaCl_2$ विलयन मिलाकर इससे $BaSO_4$ अवक्षेपित कर लिया जाता है। इस अवक्षेप को छानकर, धोकर और सुखाकर तौल लेते हैं। इस प्रकार $BaSO_4$ के भार की सहायता से गन्धक की प्रतिशत मात्रा की गणना कर लेते हैं।
अभिक्रियाएँ-
सल्फरयुक्त कार्बनिक यौगिक $+$ सान्द्र $\mathrm{HNO}_{3} \longrightarrow \mathrm{CO}_{2} \uparrow+\mathrm{H}_{2} \mathrm{O}+\mathrm{NO}_{2} \uparrow+\mathrm{H}_{2} \mathrm{SO}_{4}$
$\mathrm{H}_{2} \mathrm{SO}_{4}+\mathrm{BaCl}_{2} \longrightarrow \mathrm{BaSO}_{4} \downarrow+2 \mathrm{HCl}$
माना, $m$ ग्राम कार्बनिक यौगिक से $x$ ग्राम $\mathrm{BaSO}_{4}$ बनता है।
$\because \quad 233$ ग्राम $\mathrm{BaSO}_{4}$ में $\mathrm{S}$ की मात्रा $=32$ ग्राम
$\therefore \quad x$ ग्राम $\mathrm{BaSO}_{4}$ में $\mathrm{S}$ की मात्रा $=\frac{32}{233} \times x$ ग्राम
$\because \quad m$ ग्राम कार्बनिक यौगिक में $\mathrm{S}$ की मात्रा $=\frac{32}{233} \times x$ ग्राम
$\therefore 100$ ग्राम कार्बनिक यौगिक में $\mathrm{S}$ की मात्रा $=\frac{32}{233} \times \frac{x}{\mathrm{~m}} \times 100$
$\mathrm{S}$ की प्रतिशत मात्रा $(\%)=\frac{32}{233} \times \frac{\mathrm{BaSO}_{4} \text { का भार }}{\text { कार्बनिक यौगिक का भार }} \times 100$
फॉस्फोरस का आकंलन
कार्बनिक यौगिक की एक ज्ञातं मात्रा को सधूम नाइट्रिक अम्ल के साथ गर्म करने पर उसमें उपस्थित फॉस्फोरस, फॉस्फोरिक अम्ल में ऑक्सीकृत हो जाता है। इसे अमोनिया तथा अमोनियम मॉलिब्डेट मिलाकर अमोनियम फॉस्फोटोमॉलिब्डेट, (NH4)3 PO4.12MoO3 के रूप में हम अवक्षेपित कर लेते हैं, अन्यथा फॉस्फोरिक अम्ल में मैग्नीशिया मिश्रण मिलाकर MgN4PO4 के रूप में अवक्षेपित किया जा सकता है जिसके ज्वलन से Mg2P2O7 प्राप्त होता है।
माना कि कार्बनिक यौगिक का द्रव्यमान = m ग्राम और
अमोनियम फॉस्फोमॉलिब्डेट = m1 ग्राम
$\left(\mathrm{NH}_{4}\right)_{3} \mathrm{PO}_{4} .12 \mathrm{MoO}_{3}$ का मोलर द्रव्यमान $=1877$ ग्राम है।
फॉस्फोरस की प्रतिशतता $=\frac{31 \times m_{1} \times 100}{1877 \times m} \%$
यदि फॉस्फोरस का $\mathrm{Mg}_{2} \mathrm{P}_{2} \mathrm{O}_{7}$ के रूप में आकलन किया जाए तो
फॉस्फोरस की प्रतिशतता $=\frac{62 \times m_{1} \times 100}{222 \times m} \%$
जहाँ $\mathrm{Mg}_{2} \mathrm{P}_{2} \mathrm{O}_{7}$ का मोलर द्रव्यमान $222 \mathrm{u}$, लिए गए कार्बनिक पदार्थ का द्रव्यमान का बने हुए $\mathrm{Mg}_{2} \mathrm{P}_{2} \mathrm{O}_{7}$ का द्रव्यमान $\mathrm{m}_{1}$ तथा $\left.\mathrm{Mg}_{2} \mathrm{P}_{2} \mathrm{O}_{7}\right)$ यौगिक में उपस्थित दो फॉस्फोरस परमाणुओं काद्रव्यमान 62 है।
24. पेपर क्रोमैटोग्रॅफी के सिद्धान्त को समझाइए।
उत्तर: पेपर क्रोमैटोग्रॅफी वितरण क्रोमैटोग्रॅफी का एक प्रकार है। कागज अथवा पेपर क्रोमैटोग्रफी में एक विशिष्ट प्रकार का क्रोमैटोग्रफी पेपर प्रयोग किया जाता है। इस पेपर के छिद्रों में जल-अणु पाशित रहते हैं, जो स्थिर प्रावस्था का कार्य करते हैं।
क्रोमैटोग्रॅफी कागज की एक पट्टी के आधार पर मिश्रण का बिन्दु लगाकर उसे जार में लटका देते हैं| जार में कुछ ऊँचाई तक उपयुक्त विलायक अथवा विलायकों का मिश्रण भरा होता है, जो गतिशील प्रावस्था का कार्य करता है। केशिका क्रिया के कारण पेपर की पट्टी पर विलायके ऊपर की ओर बढ़ता है तथा बिन्दु पर प्रवाहित होता है। विभिन्न यौगिकों का दो प्रावस्थाओं में वितरण भिन्न-भिन्न होने के कारण वे अलग-अलग दूरियों तक आगे बढ़ते हैं। इस प्रकार विकसित पट्टी को ‘क्रोमैटोग्रामकहते हैं। पतली पर्त की भाँति पेपर की पट्टी पर विभिन्न बिन्दुओं की स्थितियों को या तो पराबैंगनी प्रकाश के नीचे रखकर या उपयुक्त अभिकर्मक के विलयन को छिड़ककर हम देख लेते हैं।
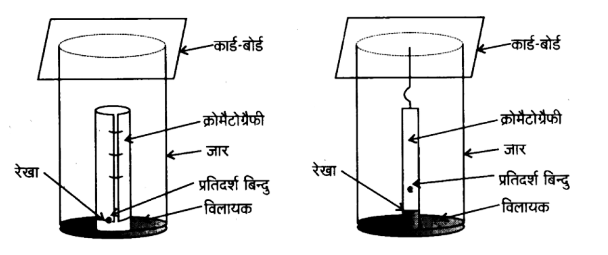
25. सोडियम संगलने निष्कर्ष में हैलोजेन के परीक्षण के लिए सिल्वर नाइट्रेट मिलाने से पूर्व नाइट्रिक अम्ल क्यों मिलाया जाता है?
उत्तर: $\mathrm{NaCN}$ तथा $\mathrm{Na}_{2} \mathrm{~S}$ को विघटित करने के लिए सोडियम निष्कर्ष को नाइट्रिक अम्ल के साथ उबाला जाता है।
$\mathrm{NaCN}+\mathrm{HNO}_{3} \rightarrow \mathrm{NaNO}_{3}+\mathrm{HCN} \uparrow$
$\mathrm{Na}_{2} \mathrm{~S}+2 \mathrm{HNO}_{3} \rightarrow 2 \mathrm{NaNO}_{3}+\mathrm{H}_{2} \mathrm{~S} \uparrow$
यदि वे विघटित नहीं होते हैं तब वे $\mathrm{AgNO}_{3}$ से अभिक्रिया करके परीक्षण में निम्न प्रकार बाधा पहुँचाते हैं-
$\mathrm{Na}_{2} \mathrm{~S}+2 \mathrm{AgNO}_{3} \longrightarrow \mathrm{Ag}_{2} \mathrm{~S}+2 \mathrm{NaNO}_{3}$
${\mathrm{NaCN}+\mathrm{AgNO}_{3} \longrightarrow \mathrm{AgCN}+\mathrm{NaNO}_{3}}$
26. नाइट्रोजन, सल्फर तथा फॉस्फोरस के परीक्षण के लिए सोडियम के साथ कार्बनिक यौगिक का संगलन क्यों किया जाता है?
उत्तर: कार्बनिक यौगिक का सोडियम के साथ संगलन सह-संयोजी रूप में उपस्थित इन तत्त्वों को आयनिक रूप में परिवर्तित करने के लिए किया जाता है।
27. कैल्सियम सल्फेट तथा कपूर के मिश्रण के अवयवों को पृथक करने के लिए एक उपयुक्त तकनीक बताइए।
उत्तर: कैल्सियम सल्फेट तथा कपूर के मिश्रण को निम्न विधियों द्वारा पृथक् किया जा सकता है-
कपूर ऊर्ध्वपातनीय है लेकिन कैल्सियम सल्फेट नहीं। अतः मिश्रण को ऊर्ध्वपातित करने पर कपूर फनल के किनारों पर प्राप्त हो जाता है जबकि कैल्सियम सल्फेट चाइना डिश में शेष रह जाता है।
कपूर कार्बनिक विलायकों, जैसे- $\mathrm{CCl}_{4}, \mathrm{CHCl}_{3}$ आदि में विलेय होता है लेकिन कैल्सियम सल्फेट नहीं। अतः मिश्रण को कार्बनिक विलायक के साथ हिलाने पर कपूर विलयन मेंच्चला जाता है जबकि $\mathrm{CaSO}_{4}$ अपशिष्ट रूप में रहता है। विलयन को छानकर, वाष्षित करके कपूर को प्राप्त कर लेते हैं।
28. भाप-आसवन करने पर एक कार्बनिक द्रव अपने क्वथनांक से निम्न ताप पर वाष्पीकृत। क्यों हो जाता है?
उत्तर: भाप आसवन में, कार्बनिक द्रव और जल का मिश्रण उस ताप पर उबलता है जिस पर द्रव तथा जल के दाबों का योग वायुमंडलीय दाब के बराबर हो जाता है। मिश्रण के क्वथनांक पर जल का वाष्प दाब उच्च तथा द्रव का वाष्प दाब अत्यधिक कम (10-15mm) होता है अत: कार्बनिक द्रव वायुमंडलीय दाब से कम दाब पर आसवित हो जाता है अर्थात् कार्बनिक द्रव अपने सामान्य क्वथनांक से कम ताप पर ही आसवित हो जाता है।
29. क्या $\mathrm{CCl}_{4}$ सिल्वर नाइट्रेट के साथ गर्म करने पर $\mathrm{AgCl}$ का श्वेत अवक्षेप देगा? अपने उत्तर को कारण सहित समझाइए।
उत्तर: $\mathrm{AgCl}$ का अवक्षेप नहीं बनेगा क्योंकि $\mathrm{CCl}_{4}$ सहसंयोजी यौगिक है तथा आयनित होकर $\mathrm{Cl}$ आयन नहीं देता है।
30. किसी कार्बनिक यौगिक में कार्बन का आकलन करते समय उत्पन्न कार्बन डाइऑक्साइड को अवशोषित करने के लिए पोटैशियम हाइड्रॉक्साइड विलयन का उपयोग क्यों किया जाता है?
उत्तर: $\mathrm{CO}_{2}$ अम्लीय प्रकृति की होती है तथा प्रबल क्षार $\mathrm{KOH}$ से क्रिया करके $\mathrm{K}_{2} \mathrm{CO}_{3}$ बनाती है।
$2 \mathrm{KOH}+\mathrm{CO}_{2} \rightarrow \mathrm{K}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{OAr}$
इससे KOH का द्रेव्यमान बढ़ जाता है। निर्मित $\mathrm{CO}_{2}$ के कारण द्रव्यमान में वृद्धि से कार्बनिक यौगिक में उपस्थित कार्बन की मात्रा की गणना निम्न सम्बन्ध का प्रयोग करके की जाती है
$\% \mathrm{C}=\frac{12}{44} \times \frac{\text { निर्मित } \mathrm{CO}_{2} \text { का द्रव्यमान }}{\text { लिए गए पदार्थ का द्रव्यमान }} \times 100$
31. सल्फर के लेड ऐसीटेटू द्वारा परीक्षण में सोडियम संगलन निष्कर्ष को ऐसीटिक अम्ल द्वारा उदासीन किया जाता है, न कि सल्फ्यूरिक अम्ल द्वारा। क्यों?
उत्तर: सल्फर के परीक्षण में सोडियम निष्कर्ष को $\mathrm{CH}_{3} \mathrm{COOH}$ से अम्लीकृत करते हैं क्योकि लेड ऐसीटेट विलेय होता है तथा परीक्षण में बाधा उत्पन्न नहीं करता है। यदि $\mathrm{H}_{2} \mathrm{SO}_{4}$ का प्रयोग किया जाए तब लेड ऐसीटेट $\mathrm{H}_{2} \mathrm{SO}_{4}$ से क्रिया करके लेड सल्फेट का सफेद अवक्षेप बनाता है जो परीक्षण में बाधा उत्पत्न करता है।
$\left(\mathrm{CH}_{3} \mathrm{COO}\right)_{2} \mathrm{~Pb}+\mathrm{H}_{2} \mathrm{SO}_{4} \longrightarrow \mathrm{PbSO}_{4}+2 \mathrm{CH}_{3} \mathrm{COOH}$
32. एक कार्बनिक यौगिक में 69% कार्बन, 4.8% हाइड्रोजन तथा शेष ऑक्सीजन है। इस यौगिक के 0.20 g के पूर्ण दहन के फलस्वरूप उत्पन्न कार्बन डाइऑक्साइड तथा जल की मात्राओं की गणना कीजिए।
उत्तर: $\%$ कार्बन $=69 \%$
$0.20 \mathrm{~g}$ यौगिक में कार्बन की मात्रा $=0.2 \times \frac{69}{100}=0.138 \mathrm{~g}$
$\%$ हाइड्रोजन $=4.8 \%$
$0.20 \mathrm{~g}$ यौगिक में हाइड्रोजन की मात्रा $=\frac{0.2 \times 4.8}{100}=0.0096 \mathrm{~g}$
अब
$\mathrm{C}=\mathrm{CO}_{2}$
$12 \mathrm{~g}$ कार्बन दहन पर देता है $=44 \mathrm{~g} \mathrm{CO}_{2}$
$0.138 \mathrm{~g}$ कार्बन दहन पर देगा $=\frac{44}{12} \times 0.138 \mathrm{~g} \mathrm{CO}_{2}=0.506 \mathrm{~g} \mathrm{CO}_{2}$
$2 \mathrm{H}=\mathrm{H}_{2} \mathrm{O}$
$2 \mathrm{~g}$ हाइड्रोजन दहन पर देता है $=18 \mathrm{~g}$ जल
$0.0096 \mathrm{~g}$ हाइड्रोजंन दहन पर देगा $=\frac{18}{2} \times 0.0096 \mathrm{~g}$ जल $=0.0864 \mathrm{~g}$ जल
33. 0.50 g कार्बनिक यौगिक को जेलदाहल विधि के अनुसार उपचारित करने पर प्राप्त अमोनिया को 0.5 M H2SO4 के 50 mL में अवशोषित किया गया। अवशिष्ट अम्ल के उदासीनीकरण के लिए 0.5 M NaOH के 50 mL की आवश्यकता हुई। यौगिक में नाइट्रोजन प्रतिशतता की गणना कीजिए।
उत्तर: कार्बनिक यौगिक का द्रव्यमान $=0.50 \mathrm{~g}$
लिए गए $0.5 \mathrm{M} \mathrm{H}_{2} \mathrm{SO}_{4}$ का आयतन $=50 \mathrm{~mL}$
अवशिष्ट अम्ल के उदासीनीकरण के लिए $0.5 \mathrm{M} \mathrm{NaOH}$ विलयन की आवश्यकता होती है। $60 \mathrm{~mL} 0.5 \mathrm{NaOH} \equiv \frac{60}{2} \mathrm{~mL} 0.5 \mathrm{M} \mathrm{H}_{2} \mathrm{SO}_{4}=30 \mathrm{~mL} 0.5 \mathrm{M} \mathrm{H}_{2} \mathrm{SO}_{4}$ विलयन
$0.5 \mathrm{M} \mathrm{H}_{2} \mathrm{SO}_{4}$ का प्रयुक्त आयतन $=50-30=20 \mathrm{~mL}$
$20 \mathrm{~mL} 0.5 \mathrm{M} \mathrm{H}_{2} \mathrm{SO}_{4} \equiv 2 \times 20 \mathrm{~mL} 0.5 \mathrm{M} \mathrm{NH}_{3}$ विलयन
$=40 \mathrm{~mL} 0.5 \mathrm{M} \mathrm{NH}_{3}$ विलयन
$1000 \mathrm{~mL} 1 \mathrm{M} \mathrm{NH}_{3}$ में नाइट्रोजन $=14 \mathrm{~g}$
$\therefore 40 \mathrm{~mL} 0.5 \mathrm{M} \mathrm{NH}_{3}$ में नाइट्रोजन $=\frac{14 \times 40 \times 0.5}{1000}=0.28 \mathrm{~g}$
$\% \mathrm{~N}=\frac{0.28}{0.5} \times 100=56 \%$
34. केरियस आकलन में 0.3780 g’कार्बनिक क्लोरो यौगिक से 0.5740 g सिल्वर क्लोराइड प्राप्त हुआ। यौगिक में क्लोरीन की प्रतिशतता की गणना कीजिए।
उत्तर: लिए गए पदार्थ का द्रव्यमान $=0.3780 \mathrm{~g}$
निर्मित $\mathrm{AgCl}$ का द्रव्यमान $=0.5740 \mathrm{~g}$
$143.5 \mathrm{~g} \mathrm{AgCl} \equiv 35.5 \mathrm{~g} \mathrm{Cl}$
$\therefore \quad 0.5740 \mathrm{~g} \mathrm{AgCl} =\frac{35.5}{143.5} \times 0.5740 \mathrm{~g} \mathrm{Cl}=0.142 \mathrm{Cl}$
$\% \mathrm{Cl} =\frac{0.142 \times 100}{0.3780}=37.57 \%$
35. केरियस विधि द्वारा सल्फर के आकलन में 0.468 g सल्फरयुक्त कार्बनिक यौगिक से 0.668 g बेरियम सल्फेट प्राप्त हुआ। दिए गए कार्बन यौगिक में सल्फर की प्रतिशतता की गणना कीजिए।
उत्तर: कार्बनिक पदार्थ का द्रव्यमान $=0.468 \mathrm{~g}$
निर्मित $\mathrm{BaSO}_{4}$ का द्रव्यमान $=0.668 \mathrm{~g}$
$1 \text { मोल } \mathrm{BaSO}_{4} \equiv 1 \mathrm{~g} \text { परमाणु }$
$233 \mathrm{~g} \mathrm{BaSO}_{4} \equiv 32 \mathrm{~g} \mathrm{~S}$
$\therefore \quad 0.668 \mathrm{~g} \mathrm{BaSO}_{4} =\frac{32}{233} \times 0.668 \mathrm{~g} \mathrm{~S}=0.0917 \mathrm{~g} \mathrm{~S}$
$\quad \% \mathrm{~S} =\frac{0.0917}{0.468} \times 100=\mathbf{1 9 . 6 0 \%}$
36.$\mathrm{CH}_{2}=\mathrm{CH}-\mathrm{CH}_{2}-\mathrm{CH}_{2}-\mathrm{C}=\mathrm{CH}$, कार्बनिक यौगिक में $\mathrm{C}_{2}-\mathrm{C}_{3}$ आबन्ध किन संकरित कक्षकों के युग्म से निर्मित होता है?
(क) sp-sp $^{2}$
(ख) sp-sp $^{3}$
(ग) $\mathrm{sp}^{2}-\mathrm{sp}^{3}$
(घ) $s p^{2}-\mathrm{sp}^{3}$
उत्तर: $(ग) \mathrm{sp}^{2}-\mathrm{sp}^{3}$
कार्बन परमाणुओं की संख्या $1,2,3,4,5$ और 6 हैं $\mathrm{sp}, \mathrm{sp}, \mathrm{sp}^{3}, \mathrm{sp}^{3}, \mathrm{sp}^{2}$
और $s p^{2}$ क्रमशः संकर्नित है।
37. किसी कार्बनिक यौगिक में लैंसे-परीक्षण द्वारा नाइट्रोजन की जाँच में प्रशियन ब्लू रंग निम्नलिखित में से किसके कारण प्राप्त होता है?
(क) $\mathrm{Na}_{4}\left[\mathrm{Fe}(\mathrm{CN})_{6} \mathrm{I}\right.$
(ख) $\mathrm{Fe}_{4}\left[\mathrm{Fe}(\mathrm{CN})_{6} \mathrm{I}_{3}\right.$
(ग) $\mathrm{Fe}_{2}\left[\mathrm{Fe}(\mathrm{CN})_{6}\right)$
(घ) $\mathrm{Fe}_{3}\left[\left.\mathrm{Fe}(\mathrm{CN})_{6}\right|_{4}\right.$
उत्तर: (ख) $\mathrm{Fe}_{4}\left[\mathrm{Fe}\left(\mathrm{CN}_{6}\right)_{3}\right.$ के गठन के कारण प्रुषियन नीला रंग है
38. निम्नलिखित कार्बधनायनों में से कौन-सा सबसे अधिक स्थायी है?
(image will be uploaded soon)
उत्तर:
(image will be uploaded soon)
39. कार्बनिक यौगिकों के पृथक्करण और शोधन की सर्वोत्तम तथा आधुनिकतम तकनीक कौन-सी है?
(क) क्रिस्टलन
(ख) आसवन
(ग) ऊर्ध्वपातन
(घ) क्रोमैटोग्रैफी
उत्तर:
(घ) क्रोमैटोग्रॅफी।
40. $\mathrm{CH}_{3} \mathrm{CH}_{2} 1+\mathrm{ROH}(\mathrm{aq}) \rightarrow \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{OH}+\mathrm{KI}$ अभिक्रिया को नीचे दिए गए प्रकार में वर्गीकृत कीजिए
(क) इलेक्ट्रॉनस्नेही प्रतिस्थापन
(ख) नाभिकस्नेही प्रतिस्थापन
(ग) विलोपन
(घ) संकलन
उत्तर:
(ख) नाभिकस्नेही प्रतिस्थापन
NCERT Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry Some Basic Principles and Techniques in Hindi
Chapter-wise NCERT Solutions are provided everywhere on the internet with an aim to help the students to gain a comprehensive understanding. Class 11 Chemistry Chapter 12 solution Hindi mediums are created by our in-house experts keeping the understanding ability of all types of candidates in mind. NCERT textbooks and solutions are built to give a strong foundation to every concept. These NCERT Solutions for Class 11 Chemistry Chapter 12 in Hindi ensure a smooth understanding of all the concepts including the advanced concepts covered in the textbook.
NCERT Solutions for Class 11 Chemistry Chapter 12 in Hindi medium PDF download are easily available on our official website (vedantu.com). Upon visiting the website, you have to register on the website with your phone number and email address. Then you will be able to download all the study materials of your preference in a click. You can also download the Class 11 Chemistry Organic Chemistry Some Basic Principles and Techniques solution Hindi medium from Vedantu app as well by following the similar procedures, but you have to download the app from Google play store before doing that.
NCERT Solutions in Hindi medium have been created keeping those students in mind who are studying in a Hindi medium school. These NCERT Solutions for Class 11 Chemistry Organic Chemistry Some Basic Principles and Techniques in Hindi medium pdf download have innumerable benefits as these are created in simple and easy-to-understand language. The best feature of these solutions is a free download option. Students of Class 11 can download these solutions at any time as per their convenience for self-study purpose.
These solutions are nothing but a compilation of all the answers to the questions of the textbook exercises. The answers/ solutions are given in a stepwise format and very well researched by the subject matter experts who have relevant experience in this field. Relevant diagrams, graphs, illustrations are provided along with the answers wherever required. In nutshell, NCERT Solutions for Class 11 Chemistry in Hindi come really handy in exam preparation and quick revision as well prior to the final examinations.
FAQs on NCERT Solutions For Class 11 Chemistry In Hindi Chapter 12 Organic Chemistry Some Basic Principles And Techniques - 2025-26
1. How are the NCERT Solutions for Class 11 Chemistry Chapter 12 structured on Vedantu?
The solutions are provided in a comprehensive, question-by-question format, following the exact sequence of the NCERT textbook for the 2025-26 session. They cover both the in-text questions and the detailed end-of-chapter exercises, ensuring no part of the syllabus is missed. Each solution is crafted by subject matter experts for clarity and accuracy.
2. What is the correct method for solving IUPAC nomenclature problems as per the NCERT solutions for Chapter 12?
The NCERT solutions provide a systematic approach for IUPAC nomenclature:
- First, identify the longest carbon chain (parent chain).
- Second, number the chain to give the lowest possible number (locant) to substituents or functional groups.
- Third, identify and name the substituents with their positions.
- Finally, assemble the name in the order: prefix (substituents), word root (parent chain), and suffix (functional group).
3. How do the NCERT Solutions explain the step-by-step process for drawing isomers in the Chapter 12 exercises?
The solutions methodically demonstrate how to identify isomers. The process starts by drawing the straight-chain structure. Then, it involves systematically reducing the parent chain length and arranging the remaining carbons as substituents (branches) at different possible positions. The solutions for each problem show how to check for unique structures and avoid duplicates, covering both structural isomerism (chain, position, functional) and stereoisomerism where applicable.
4. How do the Vedantu solutions for Chapter 12 help solve problems on the qualitative analysis of organic compounds?
The solutions provide detailed, step-by-step explanations for tests that detect elements like nitrogen, sulphur, halogens, and phosphorus. For a typical problem, the solution will:
- Clearly state the principle behind the specific test (e.g., Lassaigne's test).
- Write down the chemical reactions involved in forming the coloured precipitate or compound.
- Explain the observation and the inference drawn from it, helping you write a complete and accurate answer for your exams.
5. Why is understanding electronic displacement effects (like inductive and resonance) crucial for solving NCERT problems on the stability of reaction intermediates?
Understanding electronic effects is fundamental because they determine electron density distribution within a molecule, which directly impacts stability. The NCERT solutions explain this by showing how:
- The inductive effect (+I or -I) helps stabilise or destabilise carbocations and carbanions by donating or withdrawing electron density along a sigma bond.
- Resonance allows for the delocalisation of charge over multiple atoms, significantly increasing the stability of species like the benzyl carbocation or phenoxide ion.
6. How do the NCERT Solutions for Chapter 12 guide students in differentiating between electrophiles and nucleophiles in a reaction?
The solutions clarify this distinction by focusing on the core definitions. For any given species in a problem, the solution explains whether it is:
- An electrophile (electron-loving), meaning it is electron-deficient and seeks an electron-rich centre (e.g., H⁺, NO₂⁺, AlCl₃).
- A nucleophile (nucleus-loving), meaning it is electron-rich and attacks an electron-deficient centre (e.g., OH⁻, CN⁻, H₂O).
7. What common mistakes in solving quantitative analysis problems are addressed by Vedantu's NCERT Solutions?
The solutions help prevent common errors in quantitative analysis (Carius, Duma, Kjeldahl methods) by emphasising key details. For example, they clarify:
- The correct use of atomic and molecular masses in the calculation formula.
- The importance of balancing the chemical equations to get the correct stoichiometric ratios.
- Step-by-step unit conversions to ensure the final answer is in the required unit (e.g., percentage).
8. Beyond just solving the exercises, how do the detailed NCERT Solutions for Chapter 12 build a stronger foundation in organic chemistry?
These solutions are designed not just for homework completion but for deep learning. They build a strong foundation by:
- Explaining the 'why' behind each step, connecting the problem to a fundamental concept.
- Visually representing structures and mechanisms, which improves retention and understanding.
- Providing the most logical and efficient methods to solve problems, which builds good habits for competitive exams like JEE and NEET.



















