Step-by-Step Solutions For Class 11 Chemistry Chapter 3 In Hindi - Free PDF Download
Download the Class 11 Chemistry NCERT Solutions in Hindi medium and English medium as well offered by the leading e-learning platform Vedantu. If you are a student of Class 11, you have reached the right platform. The NCERT Solutions for Class 11 Chemistry in Hindi provided by us are designed in a simple, straightforward language, which are easy to memorise. You will also be able to download the PDF file for NCERT Solutions for Class 11 Chemistry in Hindi from our website at absolutely free of cost.
 Table of Content
Table of ContentNCERT, which stands for The National Council of Educational Research and Training, is responsible for designing and publishing textbooks for all the classes and subjects. NCERT textbooks covered all the topics and are applicable to the Central Board of Secondary Education (CBSE) and various state boards.
We, at Vedantu, offer free NCERT Solutions in English medium and Hindi medium for all the classes as well. Created by subject matter experts, these NCERT Solutions in Hindi are very helpful to the students of all classes.
Note:➤Unlock your dream college possibilities with our NEET College Predictor!
Access NCERT Solutions for Class 11 Chemistry Chapter 3 – तत्वों का वर्गीकरण एवं गुणधर्मो में आवर्तिता
1. आवर्त सारणी में व्यवस्था का भौतिक आधार क्या है?
उत्तर: समय की अवधि में वितरण का भौतिक आधार एक ही समूह में समान गुणों (भौतिक-रासायनिक) वाले तत्वों की नियुक्ति है। इन तत्वों की विशेषताएं मुख्य रूप से उनके स्वस्थ इलेक्ट्रॉनिक गोले पर आधारित होती हैं। इस प्रकार तत्वों के परमाणुओं का मान कोश के संघटन के समान ही होता है।
2. मेंडलीव ने किस महत्त्वपूर्ण गुणधर्म को अपनी आवर्त सारणी में तत्वों के वर्गीकरण का आधार बनाया? क्या वे उस पर दृढ़ रह पाए?
उत्तर: मेंडेलीव का मानना है कि परमाणु मात्रा सदस्य वर्गीकरण का आधार है और तत्वों को परमाणु द्रव्यमान के क्रम में व्यवस्थित किया है। वह सबसे नीचे खड़ा था और उनके परमाणु भार के आधार पर गुणों की भविष्यवाणी करता था जिससे उस समय के तत्व अज्ञात हो जाते थे। जब इन कारणों को जाना जाता है तो उनकी भविष्यवाणी सही होती है।
3. मेंडलीव के आवर्त नियम और आधुनिक आवर्त नियम में मौलिक अन्तर क्या है?
उत्तर: मेंडेलीव का वर्तमान कानून तत्वों की परमाणु संख्या पर आधारित है और वर्तमान कानून तत्वों की परमाणु संख्या पर आधारित है। अतः मौलिक परिवर्तन वर्गीकरण का आधार है।
4. क्वाण्टम संख्याओं के आधार पर यह सिद्ध कीजिए कि आवर्त सारणी के छठवें आवर्त में 32 तत्व होने चाहिए।
उत्तर: आवर्त सारणी के दीर्घ रूप में प्रत्येक आवर्त एक नई कक्षा के भरने से प्रारम्भ होता है। छठवाँ आवर्त(मुख्य क्वाण्टम संख्या \[ = {\text{ }}6)n{\text{ }} = {\text{ }}6\]से प्रारम्भ होता है। इस कक्ष के लिए \[n = \;6\] तथा \[! = {\text{ }}0,1,{\text{ }}2\]तथा \[3\]होगा (उच्च मान आदेशित नहीं है)।
इस प्रकार, उपकक्षाएँ \[6s,{\text{ }}6p,{\text{ }}6d\]तथा \[6\] इलेक्ट्रॉनों के समावेशन के लिए उपलब्ध हैं। किन्तु आँफबाऊ के नियमानुसार \[6d\] तथा \[6/ - \] उपकक्षाओं की ऊर्जा \[7s - \]उपकक्षाओं की तुलना में अधिक होती है। इसलिए यह कक्षाएँ \[7s\] उपकक्षाओं के भरने तक नहीं भरती हैं। इसके अतिरिक्त 5d- तथा 4- उपकक्षाओं की ऊर्जाएँ \[6p\] - उपकक्षाओं से कम होती हैं। इसलिए, छठवें आवर्त में, इलेक्ट्रॉन्स केवल \[6s,4,5d\] तथा \[6p\] - उपकक्षाओं में भरते हैं। इन उपकक्षाओं में इलेक्ट्रॉन्स की संख्याएँ क्रमशः \[2,{\text{ }}14,{\text{ }}10\]तथा \[6\]होती हैं अर्थात् कुल \[32\] इलेक्ट्रॉन्स होते हैं। इसी कारण छठवें आवर्त में \[32\] तत्त्व होते।
5. आवर्त और वर्ग के पदों में यह बताइए कि \[{\mathbf{z}}{\text{ }} = {\text{ 1}}{\mathbf{14}}\] कहाँ स्थित होगा?
उत्तर: \[{\mathbf{z}}{\text{ }} = {\text{ 1}}{\mathbf{14}}\]त तत्त्व का इलेक्ट्रॉनिक विन्यास निम्न है-
$X(Z = 114):1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2}4{p^6}4{d^{10}}4{f^{14}}$
$5 s^{2} 5 p^{6} 5 d^{10} 5 f^{14} 6 s^{2} 6 p^{6} 6 d^{10} 7 s^{2} 7 p^{2}$
या \[{\mathbf{X}}{\text{ }}\left( {{\mathbf{Z}} = {\mathbf{114}}} \right):\left[ {{\mathbf{Rn}}} \right]{\mathbf{5}}{{\mathbf{f}}^{{\mathbf{14}}}}{\mathbf{6}}{{\mathbf{d}}^{{\mathbf{10}}}}{\mathbf{7}}{{\mathbf{s}}^{\mathbf{2}}}{\mathbf{7}}{{\mathbf{p}}^{\mathbf{2}}}\]
यह स्पष्ट है कि दिया तत्त्व एक सामान्य तत्त्व है तथा आवर्त सारणी के \[p - \] ब्लॉक से सम्बन्धित है।’ चूँकि इस तत्त्व में \[n{\text{ }} = {\text{ }}7\] कक्ष में इलेक्ट्रॉन उपस्थित हैं, अत: यह आवर्त सारणी के सातवें आवर्त में स्थित होगा। इसके अतिरिक्त समूह की संख्या \[ = {\text{ }}10 + \] संयोजी इलेक्ट्रॉनों की संख्या\[ = {\text{ }}10{\text{ }} + 4{\text{ }} = {\text{ }}14\] अतः दिया गया तत्त्व सातवें आवर्त में तथा समूह \[14\] में स्थित है।
6. उस तत्व का परमाणु क्रमांक लिखिए, जो आवर्त सारणी में तीसरे आवर्त और \[17\]वें वर्ग में स्थित होता है।
उत्तर: तीसरे आवर्त में केवल \[3 - \] तथा \[3p - \] कक्षाएँ भरती हैं। अत: आवर्त में केवल दो – तथा छः\[p - \] ब्लॉक के तत्त्व होते हैं। तीसरा आवर्त \[Z = 11\] से प्रारम्भ होकर\[Z = 18\] पर समाप्त होता है। अतः Z=11 तथा \[Z = 12\]के तत्त्व -ब्लॉक में स्थित होंगे। अगले छः तत्त्व \[Z = 13\] (समूह 13) से\[Z = 18\] (समूह \[18\])\[p - \]ब्लॉक के तत्त्व हैं। इसलिए वह तत्त्व जो \[17\] वें समूह में स्थित है उसका परमाणु क्रमांक $Z = 17$ होगा।
7. कौन-से तत्व का नाम निम्नलिखित द्वारा दिया गया है?
(i) लॉरेन्स बर्कले प्रयोगशाला द्वारा
उत्तर: लॉरेन्सियम (Lawrencium) (\[Z = 103\]) तथा बर्केलियम (Berkelium) (\[Z = 97\])
(ii) सी बोर्ग समूह द्वारा।
उत्तर: सीबोर्गीयम (Seaborgium) (\[Z = 106\])
8. एक ही वर्ग में उपस्थित तत्वों के भौतिक और रासायनिक गुणधर्म समान क्यों होते हैं?
उत्तर: एक ही वर्ग में विद्यमान तत्त्वों के इलेक्ट्रॉनिक विन्यास समान होते हैं अर्थात् उनकी संयोजी कक्षा में इलेक्ट्रॉनों की संख्या समान होती है। इसी कारण से एक ही वर्ग में विद्यमान तत्त्वों के भौतिक तथा रासायनिक गुणधर्म समान होते हैं।
9. परमाणु त्रिज्या’ और ‘आयनिक त्रिज्या से आप क्या समझते हैं?
उत्तर: परमाणु त्रिज्या से तात्पर्य परमाणु का आकार है, जो परमाणु के नाभिक के केन्द्र से बाह्यतम कक्षा के इलेक्ट्रॉन की दूरी के बराबर मानी जाती है। किसी आयन की ‘आयनिक त्रिज्या’ उसके नाभिक तथा उस बिन्दु के मध्य की दूरी को माना जाता है जिस पर नाभिक का प्रभाव आयन के इलेक्ट्रॉन मेघ पर प्रभावी होता है।
10. किसी वर्ग या आवर्त में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है? इस परिवर्तन की व्याख्या आप किस प्रकार करेंगे?
उत्तर:आवर्त में परमाणु त्रिज्याएँ (Atomic Radii in Periods) किसी आवर्त में बाएँ से दाएँ चलने पर परमाणु त्रिज्याएँ नियमित क्रम में क्षार धातु से हैलोजेन तक घटती हैं; क्योंकि नाभिकीय आवेश बढ़ने के साथ-साथ बाह्यतम कोश के इलेक्ट्रॉनों की संख्या में भी वृद्धि होती है। परिणामस्वरूप बाह्यतम कोश के इलेक्ट्रॉनों को आकर्षित करने की क्षमता में भी वृद्धि होती है। इस कारण इनकी नाभिक व बाह्यतमं कोशों के बीच की दूरी क्रमशः घटती है; अत: परमाणु त्रिज्या घटती है। (यह ध्यान देने योग्य है कि यहाँ उत्कृष्ट गैसों की परमाणु त्रिज्या पर विचार नहीं किया जा रहा है। एकल परमाणु होने के कारण उनकी आबन्धित त्रिज्या बहुत अधिक है। इसलिए उत्कृष्ट गैसों की तुलना दूसरे तत्वों की सहसंयोजक त्रिज्या से न करके वाण्डरवाल्स त्रिज्या से करते हैं।)
कुछ तत्वों के लिए परमाणु त्रिज्या का मान निम्नांकित सारणी \[ - 1\] में दिया गया है-
सारणी -1 : आवर्त में परमाणु त्रिज्या के मान ( पिकोमीटर,pm म (value of atomic radii in period (in pm)) | |
परमाणु ( आवर्त II) | \[Li\] \[Be\] \[B\] \[C\] \[N\] \[O\] \[F\] |
परमाणु त्रिज्या | \[{\mathbf{152}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{111}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{88}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{77}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{70}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{70}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{74}}\] |
परमाणु ( आवर्त III) | \[Na\] \[Mg\] \[Al\] \[Si\] \[P\] \[S\] \[Cl\] |
परमाणु त्रिज्या | \[{\mathbf{186}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{160}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{143}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{117}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{110}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{104}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{99}}\] |
द्वितीय आवर्त में परमाणु त्रिज्या में परमाणु क्रमांक के साथ परिवर्तन चित्र-\[ - 1\] में प्रदर्शित वक्र द्वारा और अधिक स्पष्ट होता है। वक्र में स्पष्ट प्रदर्शित है कि नितान्त बाईं ओर स्थित क्षार धातु (\[Li\]) की परमाणु त्रिज्या अधिकतम तथा नितान्त दाईं ओर स्थित हैलोजेन (\[F\]) की परमाणु त्रिज्या का मान न्यूनतम है।
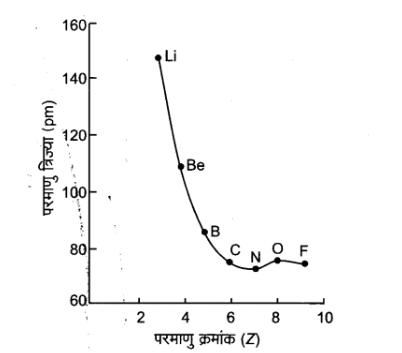
वर्ग में परमाणु त्रिज्याएँ (Atomic radii in Groups)
किसी वर्ग में ऊपर से नीचे चलने पर परमाणु त्रिज्याएँ बढ़ती हैं; क्योंकि जैसे-जैसे नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉनिक कोशों की संख्या बढ़ती जाती है, फलस्वरूप बाह्यतम कोश के इलेक्ट्रॉनों को आकर्षित करने की क्षमता घटती है; अत: परमाणु त्रिज्या बढ़ती है।
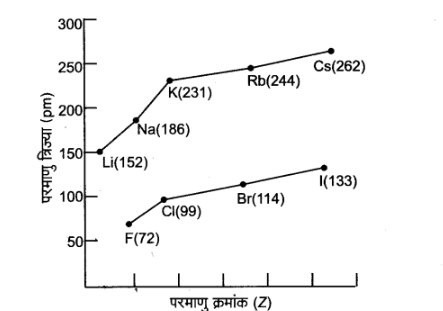
निम्नांकित सारणी\[ - 2\] में धातुओं तथा हैलोजेन तत्वों के लिए परमाणु त्रिज्याएँ दी गई हैं
सारणी -2: वर्ग में त्रिज्या का मान ( पिकोमीटर, pm में ) (values of atomic radii in group ( in pm)) | |||
परमाणु ( वर्ग \[1\] ) | परमाणु त्रिज्या | परमाणु ( वर्ग \[17\] ) | परमाणु त्रिज्या |
\[Li\] \[Na\] \[K\] \[Rb\] \[Cs\] | \[152\] \[186\] \[231\] \[244\] \[262\] | \[F\] \[Cl\] \[Br\] \[I\] \[At\] | \[72\] \[99\] \[114\] \[133\] \[140\] |
वर्ग में परमाणु क्रमांकों के साथ क्षार धातुओं तथा हैलोजेनों की परमाणु त्रिज्याओं में परिवर्तन\[ - 2\] चित्र में प्रदर्शित वक्र द्वारा और अधिक स्पष्ट होता है। मानों से यह स्पष्ट है कि लीथियम (\[Li\]) की परमाणु त्रिज्या न्यूनतम तथा सीजियम (\[Cs\]) की अधिकतम है। इसी प्रकार हैलोजेनों में फ्लुओरीन (\[F\]) की परमाणु त्रिज्या न्यूनतम तथा आयोडीन (\[I\]) की अधिकतम है।
11. समइलेक्ट्रॉनिक स्पीशीज से आप क्या समझते हैं? एक ऐसी स्पीशीज का नाम लिखिए, जो निम्नलिखित परमाणुओं या आयनों के साथ समइलेक्ट्रॉनिक होगी-
उत्तर: वे स्पीशीज (विभिन्न तत्त्वों के आयन या परमाणु) जिनमें इलेक्ट्रॉनों की संख्या समने होती है। लेकिन नाभिकीय आवेश भिन्न होता है, समइलेक्ट्रॉनिक स्पीशीज कहलाती हैं।
(i) \[F\]
उत्तर: ${{\text{F}}^ - }$में $10(9 + 1 = 10)$ इलेक्ट्रॉन हैं। इसकी समइलेक्ट्रॉनिक स्पीशीज ${{\text{N}}^{3 - }}(7 + 3 = 10)$ ${{\text{O}}^{2 - }}(8 + 2 = 10),{\text{Ne}}(10),{\text{N}}{{\text{a}}^ + }(11 - {\text{L}} = 10),{\text{A}}{{\text{l}}^{3 + }}(13 - 3 = 10)$ आदि हैं।
(ii) \[Ar\]
उत्तर : ${\text{Ar}}$ में 18 इलेक्ट्रॉन हैं। इसकी समइलेक्ट्रॉनिक स्पीशीज
${{\text{P}}^{3 - }}(15 + 3 = 18)\quad {{\text{S}}^{2 - }}(16 + 2 = 18)\quad {\text{C}}{{\text{l}}^ - }(17 + 1 = 18),\quad {{\text{K}}^ + }(19 - 1 = 18)$
${\text{C}}{{\text{a}}^{2 + }}(20 - 2 = 18)$ आदि हैं।
(iii) \[M{g^{2 + }}\]
उत्तर: ${\text{M}}{{\text{g}}^{2 + }}$ में 10 इलेक्ट्रॉन $(12 - 2 = 10)$ हैं। इसकी समइलेक्ट्रॉनिक स्पीशीज
${{\text{N}}^{3 - }}(7 + 3 = 10){{\text{O}}^{2 - }}(8 + 2 = 10),{{\text{F}}^ - }(9 + 1 = 10),{\text{Ne}}(10),{\text{N}}{{\text{a}}^ + }(11 - 1 = 10)$ आदि हैं।
(iv) \[R{b^ + }\]
उत्तर: ${\text{R}}{{\text{b}}^ + }$में 36 इलेक्ट्रॉन $(37 - 1 = 36)$ हैं। इसकी समइलेक्ट्रॉनिक स्पीशीज ${\text{B}}{{\text{r}}^ - }(35 + 1 = 36)$, $\operatorname{Kr} (36),{\text{S}}{{\text{r}}^{2 + }}(38 - 2 = 36)$ आदि हैं।
12. निम्नलिखित स्पीशीज पर विचार कीजिए- –
\[{{\mathbf{N}}^{{\mathbf{3}} - }},{{\mathbf{O}}^{{\mathbf{2}} - }},{\text{ }}{{\mathbf{F}}^--},{\text{ }}{\mathbf{N}}{{\mathbf{a}}^ + },{\text{ }}{\mathbf{M}}{{\mathbf{g}}^{{\mathbf{2}} + }}\] तथा \[{\mathbf{A}}{{\mathbf{l}}^{{\mathbf{3}} + }}\]
(क) इनमें क्या समानता है? |
उत्तर: दी गई प्रत्येक स्पीशीज में \[10\] इलेक्ट्रॉन हैं। अत: ये सब समइलेक्ट्रॉनिक स्पीशीज हैं।
(ख) इन्हें आयनिक त्रिज्या के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर: समइलेक्ट्रॉनिक आयनों की आयनिक त्रिज्या, परमाणु आवेश के बढ़ने के साथ घटती है। दी।
गई स्पीशीज के परमाणु आवेश निम्नवत् हैं-
\[{{{\text{N}}^3}: + 7}\;\;\;{\;{{\text{F}}^ - }: + 9}\;\;\;{{\text{M}}{{\text{g}}^{2 + }}: + 12}\]
\[{{{\text{O}}^{2 - }}: + 8}\;\;\;{{\text{N}}{{\text{a}}^ + }: + 11}\;\;\;{{\text{A}}{{\text{l}}^{3 + }}: + 13}\]
अत: इनका परमाणु त्रिज्याओं का बढ़ता क्रम निम्नवत् है-
$\xrightarrow{{{\text{A}}{{\text{l}}^{3 + }} < {\text{M}}{{\text{g}}^{2 + }} < {\text{N}}{{\text{a}}^ + } < {{\text{F}}^ - } < {{\text{O}}^{2 - }} < {{\text{N}}^{3 - }}}}$
आयनिक त्रिज्या बढ़ती है
13. धनायन अपने जनक परमाणुओं से छोटे क्यों होते हैं और ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक क्यों होती है? व्याख्या कीजिए।
उत्तर: जनक परमाणुओं से एक या अधिक इलेक्ट्रॉनों के निकलने पर प्रभावी नाभिकीय आवेश बढ़ता है। इस प्रकार बचे हुए इलेक्ट्रॉन अधिक नाभिकीय आकर्षण का अनुभव करते हैं। परिणामस्वरूप त्रिज्या घटती है। इसी कारण धनायन की त्रिज्या उनके जनक परमाणु से छोटी होती है। दूसरी ओर, जनके परमाणुओं में एक या अधिक इलेक्ट्रॉन बढ़ने पर प्रभावी नाभिकीय आवेश घटता है। इस प्रकार, इलेक्ट्रॉन कम नाभिकीय आकर्षण या खिंचाव अनुभव करते हैं। परिणामस्वरूप त्रिज्या बढ़ती है। इसी कारण से ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक होती है।
14. आयनन एन्थैल्पी और इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करने में विलगित गैसीय परमाणु तथा ‘आद्य अवस्था पदों की सार्थकता क्या है?
उत्तर: किसी परमाणु के नाभिक द्वारा उसमें उपस्थित इलेक्ट्रॉनों पर आरोपित बल काफी मात्रा में अणु में उपस्थित अन्य परमाणुओं तथा पड़ौसी परमाणुओं की उपस्थिति पर निर्भर करता है। चूंकि इस बल का परिमाण आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी के मानों को निर्धारित करता है, अतः इन्हें विलगित परमाणुओं के लिए परिभाषित करना आवश्यक है। एक अकेले परमाणु को विलगित करना सम्भव नहीं है। चूंकि गैसीय अवस्था में परमाणु (या अणु) काफी अलग होते हैं, आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी गैसीय परमाणुओं के लिए परिभाषित की जाती है तथा यह माना जाता है कि वे विलगित हैं। इसके अतिरिक्त आद्य अवस्था (ground state) निम्नतम ऊर्जा की अवस्था अर्थात् सबसे अधिक स्थाई अवस्था को निर्देशित करती है। यदि परमाणु उत्तेजित अवस्था में है, तो इसकी ऊर्जा का एक निश्चित मान होगा और इस अवस्था में आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी के मान भिन्न होंगे। अतः आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करते समय एक गैसीय परमाणु को आद्य अवस्था में स्थित होना आवश्यक है।
15. हाइड्रोजन परमाणु में आद्य अवस्था में इलेक्ट्रॉन की ऊर्जा \[ - {\mathbf{2}}.{\mathbf{18}}{\text{ }}{\mathbf{x}}{\text{ }}{\mathbf{1}}{{\mathbf{0}}^{ - {\mathbf{18}}}}\] J है। परमाणविक हाइड्रोजन की आयनन एन्थैल्पी \[{\mathbf{Jmo}}{{\mathbf{l}}^{ - {\mathbf{1}}}}\;\]के पदों में परिकलित कीजिए।
उत्तर: हाइड्रोजन परमाणु की आद्य अवस्था से इलेक्ट्रॉन निकालने के लिए आवश्यक ऊर्जा
\[= {E_\infty } - {E_1} = 0 - \left( { - 2.18 \times {{10}^{ - 18}}} \right)\] \[= 2.18 \times {10^{ - 18}}{\mathbf{J}}{\text{ atom}}{{\text{ }}^{ - 1}}\]
परमाणविक हाइड्रोजन की आयनन एन्थैल्पी
$ = 2.18 \times {10^{ - 18}} \times 6.022 \times {10^{23}}\;{\text{J}}\;{\text{mo}}{{\text{l}}^{ - 1}}$
$ = {\mathbf{1}}.{\mathbf{313}} \times {\mathbf{1}}{{\mathbf{0}}^6}\;{\text{J}}\;{\text{mo}}{{\text{l}}^{ - 1}}$
16. द्वितीय आवर्त के तत्वों में वास्तविक आयनन एन्थैल्पी का क्रम इस प्रकार है
\[{\mathbf{Li}} < {\text{ }}{\mathbf{B}}{\text{ }} < {\text{ }}{\mathbf{Be}} < {\mathbf{C}} < {\text{ }}{\mathbf{O}} < {\text{ }}{\mathbf{N}}{\text{ }} < {\text{ }}{\mathbf{F}}{\text{ }} < {\text{ }}{\mathbf{Ne}}\] व्याख्या कीजिए कि
(i) \[{\mathbf{Be}}\] की \[\Delta {\mathbf{i}},{\mathbf{H}},{\text{ }}{\mathbf{B}}\] से अधिक क्यों है?
उत्तर: \[{\mathbf{Be}}\] तथा \[{\mathbf{B}}\] के इलेक्ट्रॉनिक विन्यास निम्नांकित प्रकार हैं
\[_4Be = {\text{ }}2,2\] या \[1{s^2},2{s^2}\]
\[_5B = {\text{ }}2,{\text{ }}3\] या \[1{s^2},2{s^2}2{p^1}\]
बोरॉन (B) में, इसके एक \[2p\] कक्षक में एक अयुग्मित इलेक्ट्रॉन है। बेरिलियम (\[{\mathbf{Be}}\]) में युग्मित : इलेक्ट्रॉनों वाले पूर्ण-पूरित ls तथा \[25\] कक्षक हैं।
जब हम एक ही मुख्य क्वाण्टम ऊर्जा स्तर पर विचार करते हैं तो \[5 - \] इलेक्ट्रॉन \[p - \] इलेक्ट्रॉन की तुलना में नाभिक की ओर अधिक आकर्षित होता है। बेरिलियम में बाह्यतम इलेक्ट्रॉन, जो अलग किया जाएगा, वह \[5 - \] इलेक्ट्रॉन होगा, जबकि बोरॉन में बाह्यतम इलेक्ट्रॉन (जो अलग किया जाएगा) \[p - \]इलेक्ट्रॉन होगा। उल्लेखनीय है कि नाभिक की ओर \[2 - \] इलेक्ट्रॉन का भेदन (penetration) \[2p - \] इलेक्ट्रॉन की तुलना में अधिक होता है। इस प्रकार बोरॉन का \[2p - \] इलेक्ट्रॉन बेरिलियम के \[25 - \] इलेक्ट्रॉन की तुलना में आन्तरिक क्रोड इलेक्ट्रॉनों द्वारा अधिक परिरक्षित होता है। चूंकि बेरिलियम के इलेक्ट्रॉन की तुलना में बोरॉन को \[2p - \] इलेक्ट्रॉन अधिक सरलता से पृथक् हो जाता है; अत: बेरिलियम की तुलना में बोरॉन की प्रथम आयनन एन्थैल्पी (∆iH) का मान कम होगा।
(ii) \[{\mathbf{O}}\] की \[\Delta {\mathbf{i}},{\mathbf{H}},{\text{ }}{\mathbf{N}}\] और \[{\mathbf{F}}\] से कम क्यों है?
उत्तर: नाइट्रोजन तथा ऑक्सीजन के इलेक्ट्रॉनिक विन्यास निम्नांकित प्रकार हैं या
\[_7N{\text{ }} = {\text{ }}2,5\] या \[1{s^2},{\text{ }}2{s^2}2{p^1}x{\text{ }}2{p^1}_y2{p^1}_z\]
\[_8O = {\text{ }}2,6\] या \[1{s^2},{\text{ }}2{s^2}2{p^2}x{\text{ }}2{p^1}y{\text{ }}2{p^1}_z\]
स्पष्ट है कि नाइट्रोजन में तीनों बाह्यतम 2p-इलेक्ट्रॉन विभिन्न \[p - \] कक्षकों में वितरित हैं (हुण्ड का नियम), जबकि ऑक्सीजन के चारों \[2p - \] इलेक्ट्रॉनों में से दो \[2p - \]इलेक्ट्रॉन एक ही \[2p - \] ऑर्बिटल में हैं; फलतः \[2p - \]इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। फलस्वरूप नाइट्रोजन के तीनों इलेक्ट्रॉनों में से एक इलेक्ट्रॉन पृथक् करने की तुलना में ऑक्सीजन के चारों \[2p - \] इलेक्ट्रॉनों में से चौथे इलेक्ट्रॉन को पृथक् करना सरल हो जाता है; अतः\[6\] की प्रथम आयनन एन्थैल्पी (∆iH) का मान से कम होता है। यही स्पष्टीकरण\[F\] के लिए भी दिया जा सकता है।
17. आप इस तथ्य की व्याख्या किस प्रकार करेंगे कि सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की प्रथम आयनन एन्थैल्पी से कम है, किन्तु इसकी द्वितीय आयनन एन्थैल्पी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक है?
उत्तर: \[Na\] तथा \[Mg\] के इलेक्ट्रॉनिक विन्यास निम्न हैं-
$ {Na{\text{ }}\left( {Z = {\text{ }}11} \right):{\text{ }}1{s^2}2{s^2}2{p^6}3{s^1}} \\ $
$ {Mg{\text{ }}\left( {Z = {\text{ }}12} \right):{\text{ }}1{s^2}2{s^2}2{p^6}3{s^2}} \\ $
चूँकि सोडियम (\[ + 11\]) ; में मैग्नीशियम’\[( + 12)\] की तुलना में कम नाभिकीय आवेश है, सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की तुलना में कम होगी।
प्रथम इलेक्ट्रॉन निकलने के बाद, सोडियम \[Na + \] आयन में परिवर्तित हो जाता है तथा मैग्नीशियम \[Mg + \] में। इनका इलेक्ट्रॉनिक विन्यास निम्न प्रकार से होगा-
$ {Na + {\text{ }}:{\text{ }}1{s^2}2{s^2}2{p^6}} \\ $
$ {Mg + {\text{ }}:{\text{ }}1{s^2}2{s^2}2{p^6}3{s^1}} $
\[Na + \] आयन का इलेक्ट्रॉनिक विन्यास निऑन के समान एक बहुत अधिक स्थाई इलेक्ट्रॉनिक विन्यास , है। इसलिए \[Na + \] आयन से \[Mg\]की तुलना में इलेक्ट्रॉन निकालने के लिए अधिक ऊर्जा की आवश्यकता होगी। इसी कारण से सोडियम की द्वितीय आयनन एन्थैल्पी, मैग्नीशियम की तुलना में अधिक होती है।
18. मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के कौन-से कारक हैं?
उत्तर: मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के विभिन्न कारक निम्नलिखित हैं-
1. समूह में नीचे जाने पर नाभिकीय आवेश बढ़ता है।
2. समूह में नीचे जाने पर प्रत्येक तत्व में नए कोश जुड़ जाने के कारण परमाणु आकार बढ़ जाते ।
3. समूह में नीचे जाने पर आन्तरिक इलेक्ट्रॉनों की संख्या बढ़ जाती है। इससे बाह्यतम इलेक्ट्रॉनों पर आवरण-प्रभाव घट जाता है।
परमाणु आकार में वृद्धि तथा आवरण-प्रभाव का संयुक्त प्रभाव नाभिकीय आवेश में वृद्धि के प्रभाव से अधिक हो जाता है। ये प्रभाव इस प्रकार कार्य करते हैं कि नाभिक तथा बाह्यतम इलेक्ट्रॉनों के मध्य आकर्षण बल कम हो जाता है। परिणामस्वरूप समूह में नीचे जाने पर आयनन एन्थैल्पी कम हो जाती है।
19. वर्ग \[13\] के तत्वों की प्रथम आयनन एन्थैल्पी के मान (\[{\mathbf{kJ}}{\text{ }}{\mathbf{mo}}{{\mathbf{l}}^{ - {\mathbf{1}}}}\]) में इस प्रकार हैं-
$ {\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\mathbf{B}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{Al}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{Ga}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{In}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{Tl}}} \\ $
$ {\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\mathbf{801}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{577}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{579}}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{558}}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{586}}} \\ $
सामान्य से इस विचलन की प्रवर्ति की व्याख्या आप किस प्रकार करेंगे ?
उत्तर: सामान्य परम्परा के अनुसार वर्ग \[13\]में ऊपर से नीचे जाने पर आयनन एन्थैल्पी घटती है। लेकिन Ga तथा\[T1\] इसके अपवाद हैं। \[d\]तथा इलेक्ट्रॉनों का परिरक्षण प्रभाव (shielding effect) \[5\] तथा \[2\]इलेक्ट्रॉनों की तुलना में कम होता है। \[Ga\]में इलेक्ट्रॉन होते हैं, जबकि \[T1\]में तथा \[47\] इलेक्ट्रॉन होते हैं। कम परिरक्षण प्रभाव के कारण, \[Ga\]तथा\[{T_1}\] परमाणुओं के नाभिक संयोजी इलेक्ट्रॉन को मजबूती से बाँधे रखते हैं। इसी कारण से पड़ौसी तत्त्वों की तुलना में इनकी आयनन एन्थैल्पी अधिक होती है।
20. तत्वों के निम्नलिखित युग्मों में किस तत्व की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी?
(i) \[{\mathbf{O}}\]या \[{\mathbf{F}}\]
उत्तर: \[{\mathbf{F}}\]की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी। \[{\mathbf{O}}\]से \[{\mathbf{F}}\]तक जाने में, परमाणु आकार घटता है तथा नाभिकीय आवेश बढ़ता है। ये दोनों कारक फ्लुओरीन की इलेक्ट्रॉन लब्धि एन्थैल्पी के मान को अधिक ऋणात्मक बनाते हैं क्योंकि ये आने वाले इलेक्ट्रॉन के लिए नाभिकीय आकर्षण में वृद्धि करते हैं।
(ii) \[{\mathbf{F}}\]या \[Cl\]
उत्तर: \[Cl\]की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होती है।
21. आप क्या सोचते हैं कि \[{\mathbf{O}}\]की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी के समान धनात्मक, अधिक ऋणात्मक या कम ऋणात्मक होगी? अपने उत्तर की पुष्टि कीजिए।
उत्तर: ऑक्सीजन (\[{\mathbf{O}}\]) की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है। उदासीन ऑक्सीजन परमाणु में प्रथम इलेक्ट्रॉन के जुड़ने पर ऊर्जा का निष्कासन होता है तथा प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक होती है।
\[O\left( g \right) + {e^--} \to {\text{ }}{O^--}\left( g \right);{\text{ }}\Delta eg\]\[H = {\text{ }} - 141.0{\text{ }}kJ\]
और अधिक इलेक्ट्रॉन के जुड़ने के लिए ऊर्जा का अवशोषण आवश्यक है।
\[{O^--}\left( g \right) + {e^--} \to {\text{ }}{O^{2 - }}\left( g \right);{\text{ }}\Delta eg\] \[H = {\text{ }} + 780.0{\text{ }}kJ\]
इसका कारण यह है कि ऋण आवेशित \[O\] आयन तथा आने वाले इलेक्ट्रॉन के बीच प्रबल विद्युत स्थैतिक प्रतिकर्षण होता है। इस स्थिति में इलेक्ट्रॉन को जोड़ने के लिए ऊर्जा का अवशोषण आवश्यक है जो विद्युत स्थैतिक प्रतिकर्षण पर विजय प्राप्त करता है। इसी कारण से ऑक्सीजन की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है।
22. इलेक्ट्रॉन लब्धि एन्थैल्पी और इलेक्ट्रॉन ऋणात्मकता में क्या मूल अन्तर है?
उत्तर: इलेक्ट्रॉन लब्धि एन्थैल्पी किसी विलगित गैसीय परमाणु की एक अतिरिक्त इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति को संदर्भित करती है, जबकि विद्युत ऋणात्मकता किसी परमाणु के द्वारा सहसंयोजक बध में साझे के युग्मित इलेक्ट्रॉन को अपनी ओर खींचने की प्रवृत्ति है। इस प्रकार ये दोनों गुण एक-दूसरे से बिल्कुल भिन्न हैं, जबकि दोनों एक परमाणु द्वारा इलेक्ट्रॉन को आकर्षित करने की प्रवृत्ति को संदर्भित करते हैं।
23. सभी नाइट्रोजन यौगिकों में \[N\] की विद्युत ऋणात्मकता पॉलिंग पैमाने पर \[3.0\] है। आप इस कथन पर अपनी क्या प्रतिक्रिया देंगे?
उत्तर: यह कथन विवादास्पद है क्योंकि एक परमाणु की विद्युत ऋणात्मकता उसके सभी यौगिकों में स्थिर नहीं होती है। यह संकरण अवस्था तथा ऑक्सीकरण अवस्था के साथ बदलती है। उदाहरण के लिए, \[NO\], तथा \[NO\] में \[N\] की विद्युत ऋणात्मकता, ऑक्सीकरण अवस्थाओं में भिन्नता के कारण, भिन्न होती है।
24. उस सिद्धान्त का वर्णन कीजिए, जो परमाणु की त्रिज्या से सम्बन्धित होता है,
(i) जब वह इलेक्ट्रॉन प्राप्त करता है।
उत्तर: जब परमाणु एक या अधिक इलेक्ट्रॉन प्राप्त करता है, तब ऋणायन बनता है। परमाणु के ऋणायन में परिवर्तन के दौरान एक या अधिक इलेक्ट्रॉन परमाणु के संयोजी कोश से जुड़ जाते हैं। नाभिकीय आवेश जनक परमाणु के समान ही रहता है। संयोजी कोश में इलेक्ट्रॉनों की संख्या में वृद्धि, इलेक्ट्रॉनों द्वारा परस्परीय परिरक्षण की अधिकता के कारण, प्रभावी नाभिकीय आवेश को कम कर देती है। परिणामस्वरूप इलेक्ट्रॉन-मेघ विस्तृत हो जाता है अर्थात् आयनिक त्रिज्या बढ़ जाती है।
(ii) जब वह इलेक्ट्रॉन का त्याग करता है।
उत्तर: जब परमाणु एक या अधिक इलेक्ट्रॉनों का त्याग करता है, तब धनायन बनता है। इस प्रकार प्राप्त धनायन सदैव अपने जनक परमाणु से आकार में छोटा होता है। ऐसा निम्नलिखित कारणों से हो सकता है-
- संयोजी कोश के विलोपन द्वारा (\[By{\text{ }}elimination{\text{ }}of{\text{ }}valence{\text{ }}shell\])-कुछ स्थितियों में, इलेक्ट्रॉन त्यागने पर संयोजी कोश को पूर्णतया विलोपन हो जाता है। बाह्यतम कोश विलुप्त होने के कारण धनायन के आकार में कमी आ जाती है।
- प्रभावी नाभिकीय आवेश में वृद्धि के द्वारा (\[By{\text{ }}increase{\text{ }}in{\text{ }}effective{\text{ }}nuclear{\text{ }}charge\])-धनायन में, इलेक्ट्रॉनों की संख्या जनक परमाणु से कम होती है। कुल नाभिकीय आवेश समान रहता है। यह प्रभावी नाभिकीय आवेश को बढ़ा देता है। परिणामस्वरूप, इलेक्ट्रॉन नाभिक से अधिक दृढ़ता से जुड़े रहते हैं जिससे इनके आकार में कमी आ जाती है।
25. किसी तत्व के दो समस्थानिकों की प्रथम आयनन एन्थैल्पी समान होगी या भिन्न? आप क्या मानते हैं? अपने उत्तर की पुष्टि कीजिए।
उत्तर: एक तत्त्व के समस्थानिकों में इलेक्ट्रॉनों की संख्या, परमाणु नाभिकीय आवेश तथा आकार समान होता है। इसलिए इनकी प्रथम आयनन एन्थैल्पी के मान समान होते हैं।
26. धातुओं और अधातुओं में मुख्य अन्तर क्या है?
उत्तर: धातुएँ विद्युत धनात्मक तत्त्व हैं तथा एक या अधिक संयोजी इलेक्ट्रॉनों को त्यागकर धनायनों का निर्माण करती हैं। ये एक अपचायक के रूप में कार्य करती हैं तथा इनकी आयनन एन्थैल्पी, इलेक्ट्रॉनिक लब्धि एन्थैल्पी तथा विद्युत ऋणात्मकता का मान कम होता है। ये बेसिक ऑक्साइड्स बनाती हैं। दूसरी तरफ, अधातुएँ विद्युत ऋणात्मक तत्त्व हैं तथा अपने संयोजी कक्ष में एक या अधिक इलेक्ट्रॉन ग्रहण कर ऋणायन बनाने की प्रवृत्ति दर्शाती हैं। ये ऑक्सीकारक के रूप में कार्य करती हैं। इनकी आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा विद्युत ऋणात्मकता के मान अधिक होते हैं। ये अम्लीय ऑक्साइड बनाती हैं।
27. आवर्त सारणी का उपयोग करते हुए निम्नलिखित प्रश्नों के उत्तर दीजिए
(क) उस तंव का नाम बताइए जिसके बाह्य उप-कोश में पाँच इलेक्ट्रॉन उपस्थित हों।
उत्तर: \[F(1{s^2}2{s^2}2{p^5})\]
(ख) उस तत्व का नाम बताइए जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को त्यागने की हो।
उत्तर: \[Mg{\text{ }}(1{s^2}2{s^2}2{p^6}3{s^{2)}};{\text{ }}Mg{\text{ }} \to {\text{ }}M{g^{2 + }} + 2{\text{ }}{e^--}\]
(ग) उस तत्व का नाम बताइए जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को प्राप्त करने की हो।
उत्तर: \[O(1{s^2}2{s^2}2{p^4});{\text{ }}0 + 2e--{\text{ }} \to {\text{ }}02 - \]
(घ) उस वर्ग का नाम बताइए जिसमें सामान्य ताप पर धातु, अधातु, द्रव और गैस उपस्थित हों।
उत्तर: द्रव धातुएँ : \[Hg\] (वर्ग ) तथा \[Ga\] (वर्ग ) हैं।
द्रव अधातुएँ ब्रोमीन (वर्ग \[17\]) हैं। गैसीय अधातुएँ : फ्लुओरीन तथा क्लोरीन (वर्ग\[17\]), ऑक्सीजन (वर्ग \[16\]), नाइट्रोजन (वर्ग\[15\] ) इत्यादि।
28. प्रथम वर्ग के तत्वों के लिए अभिक्रियाशीलता का बढ़ता हुआ क्रम इस प्रकार है\[ - {\text{ }}{\mathbf{Li}}{\text{ }} < {\text{ }}{\mathbf{Na}}{\text{ }} < {\text{ }}{\mathbf{K}}{\text{ }} < {\text{ }}{\mathbf{Rb}}{\text{ }} < {\text{ }}{\mathbf{Cs}}\]; जबकि वर्ग के तत्वों में क्रम \[{\mathbf{F}}{\text{ }} > {\text{ }}{\mathbf{Cl}} > {\text{ }}{\mathbf{Br}} > {\mathbf{I}}\] है।
इसकी व्याख्या कीजिए।
उत्तर: वर्ग \[1\] के तत्त्व विद्युत धनात्मक तत्त्व होते हैं तथा संयोजी इलेक्ट्रॉन को त्यागकर एकल धनात्मक धनायन बनाते हैं। इनकी क्रियाशीलता आयनन एन्थैल्पी के मान पर निर्भर करती है। यदि आयनन एन्थैल्पी का मान कम है तो क्रियाशीलता अधिक होती है। चूंकि वर्ग में नीचे जाने पर, आयनन एन्थैल्पी का मान घटता है, अतः प्रथम वर्ग के तत्त्वों की क्रियाशीलता वर्ग में नीचे जाने पर बढ़ती है। (अर्थात् इस क्रम में, \[Li{\text{ > }}Cl{\text{ }} > {\text{ }}Br > {\text{ }}I\])
29. \[s - ,{\text{ }}{\mathbf{p}} - ,{\text{ }}{\mathbf{d}}\] और \[f\] -ब्लॉक के तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
(i) \[s\] -ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास \[n{s^{1 - 2}}\] (अर्थात्\[ns1\] या \[ns2\]) ) होता है।
(ii) \[{\mathbf{p}}\] -ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास \[n{s^2}n{p^{1 - 6}}\] होता है।
(iii) \[{\mathbf{d}}\] -ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास \[\left( {n - 1} \right){\text{ }}{d^{1 - 10}}{\text{ }}n{s^{1 - 2}}\]होता है।
(iv) \[f\] -ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास \[\left( {n - 2} \right){\text{ }}{f^{1 - 14}}{\text{ }}\left( {n - 1} \right){\text{ }}4{d^{0 - 1}}n{s^2}\]होता है।
30. तत्व, जिसका बाह्य इलेक्ट्रॉनिक विन्यास निम्नलिखित है, का स्थान आवर्त सारणी में बताइए-
(i) \[{\mathbf{n}}{{\mathbf{s}}^{\mathbf{2}}}{\mathbf{n}}{{\mathbf{p}}^{\mathbf{4}}},\] जिसके लिए \[n = 3\] है।
उत्तर: दिया गया तत्त्व तीसरे आवर्त (\[n = 3\]) में उपस्थित है तथा इसके संयोजी कक्ष में \[6(2 + 4)\] इलेक्ट्रॉन उपस्थित हैं। यह एक \[{\mathbf{p}} - \]ब्लॉक तत्त्व है क्योंकि विभेदी (differentiating) इलेक्ट्रॉन \[{\mathbf{p}} - \]उपकक्ष में प्रवेश करता है।
∴ वर्ग की संख्या\[ = {\text{ }}10 + \] संयोजी इलेक्ट्रॉनों की संख्या \[ = {\text{ }}10 + 6 = 16\]
इस प्रकार, यह तत्त्व तीसरे आवर्त तथा वर्ग 16 में स्थित है। यह सल्फर (S) है।
(ii) \[\left( {{\mathbf{n}} - {\mathbf{1}}} \right){\text{ }}{{\mathbf{d}}^{\mathbf{2}}}{\text{ }}{\mathbf{n}}{{\mathbf{s}}^{\mathbf{2}}}\], जब \[n = 4\]है तथा
उत्तर: दिया गया तत्त्व चौथे आवर्त (\[n = 4\]) में स्थित है। यह एक \[4\]-ब्लॉक तत्त्व है क्योंकि d-उपकोश अपूर्ण है।
∴ वर्ग की संख्या \[ = {\text{ }}2 + {\text{ }}\left( {n - 1} \right)d\] इलेक्ट्रॉनों की संख्या \[ = {\text{ }}2 + 2 = 4\]
इस प्रकार यह तत्त्व चौथे आवर्त तथा समूह \[4\]में स्थित है। यह \[Ti\] (टाइटेनियम) है।
(iii) \[\left( {{\mathbf{n}} - {\mathbf{2}}} \right){{\mathbf{f}}^{\mathbf{7}}}{\text{ }}\left( {{\mathbf{n}} - {\mathbf{1}}} \right){\text{ }}{{\mathbf{d}}^{\mathbf{1}}}{\text{ }}{\mathbf{n}}{{\mathbf{s}}^{\mathbf{2}}}\], जब \[n = 6\] है।
उत्तर: दिया गया तत्त्व छठवें आवर्त में स्थित है। यह एक f-ब्लॉक तत्त्व है क्योंकि विभेदी इलेक्ट्रॉन (\[n - 2\])f उपकक्ष में प्रवेश करता है। यह तत्त्व वर्ग \[3\]में स्थित है क्योंकि सभी \[f\]-ब्लॉक के तत्त्वों को तीसरे वर्ग में रखा गया है। यह तत्त्व Gd (gadolinium) है।
31. कुछ तत्वों की प्रथम ∆iH1 और द्वितीय ∆iH2 आयनन एन्थैल्पी (kJ mol-1 में) और इलेक्ट्रॉन लब्धि एन्थैल्पी (∆egH) (kJ mol-1 में) निम्नलिखित है-
तत्व ∆iH1 ∆iH2 ∆egH
$ {{\mathbf{I}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{520}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{7300}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }} - {\mathbf{60}}} \\ $
$ {{\mathbf{II}}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{419}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{3051}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }} - {\mathbf{48}}} \\ $
$ {{\mathbf{III}}{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{1681}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{3374}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }} - {\mathbf{328}}} \\ $
$ {{\mathbf{IV}}{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{1008}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{1846}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }} - {\mathbf{295}}} \\ $
$ {{\mathbf{V}}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{2372}}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{5251}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }} + {\mathbf{48}}} \\ $
$ {{\mathbf{VI}}{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{738}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}{\mathbf{1451}}{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }}\;{\text{ }} - {\mathbf{40}}} $
(क) सबसे कम अभिक्रियाशील धातु है?
उत्तर: तत्त्व \[5\], क्योंकि इस प्रथम आयनन एन्थैल्पी का मान सर्वाधिक है तथा इलेक्ट्रॉन लब्धि एन्थैल्पी का मान धनात्मक है। यह कर्म क्रियाशील धातु है। यह एक उत्कृष्ट गैस होनी चाहिये।
(ख) सबसे अधिक अभिक्रियाशील धातु है?
उत्तर: तत्त्व \[2\], क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान न्यूनतम तथा इलेक्ट्रॉन लब्धि एन्थैल्पी का मान कम है। इसे अधिक क्रियाशील धातु होना चाहिए। यह एक क्षारीय धातु होनी चाहिए।
(ग) सबसे अधिक अभिक्रियाशील अधातु है?
उत्तर: तत्त्व \[3\], क्योंकि इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान उच्च ऋणात्मक तथा प्रथम आयनन एन्थैल्पी का मान पर्याप्त उच्च है। यह एक हैलोजन (\[halogen\]) होना चाहिए।
(घ) सबसे कम अभिक्रियाशील अधातु है?
उत्तर: तत्त्व \[4\], क्योंकि इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान उच्च ऋणात्मक तथा प्रथम आयनन एन्थैल्पी का मान काफी कम है। इसे सबसे कम क्रियाशील अधातु होना चाहिए। यह सम्भवतः एक ‘ कम क्रियाशील हैलोजन है।
(ङ) ऐसी धातु है, जो स्थायी द्विअंगी हैलाइड (\[{\mathbf{binary}}{\text{ }}{\mathbf{halide}}\]), जिनका सूत्र \[{\mathbf{MX}},\] (\[{\mathbf{X}}\]= हैलोजेन) है, बनाता है।
उत्तर: तत्त्व \[6\], क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान यद्यपि कम है, लेकिन फिर भी क्षार धातुओं से अधिक है। इसे एक मृदा क्षारीय धातु होना चाहिए। यह \[{\mathbf{MX}},\], प्रकार के द्विअंगी हैलाइड का निर्माण करेगा।
(च) ऐसी धातु, जो मुख्यतः \[{\mathbf{MX}},\] (\[{\mathbf{X}}\]= हैलोजेन) वाले स्थायी सहसंयोजी हैलाइड बनाती है।
उत्तर: तत्त्व \[1\], क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान कम है लेकिन द्वितीय आयतन एन्थैल्पी का मान बहुत अधिक है। यह एक क्षारीय धातु है। यह \[Li\]होना चाहिए क्योंकि यह सूत्र \[{\mathbf{MX}},\]का स्थायी सहसंयोजी हैलाइड बनाता है।
32. तत्वों के निम्नलिखित युग्मों के संयोजन से बने स्थायी द्विअंगी यौगिकों के सूत्रों की प्रगुक्ति कीजिए-
(क) लीथियम और ऑक्सीजन
उत्तर: लीथियम की संयोजकता (\[201\], वर्ग \[1\] ) \[1\] है, जबकि ऑक्सीजन (\[2{s^2}2{p^4}\], वर्ग\[16\]) की \[2\] है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक Li20 है।
(ख) मैग्नीशियम और नाइट्रोजन
उत्तर: मैग्नीशियम ((\[3{s^2}\], वर्ग (\[2\] ) की संयोजकता है, जबकि नाइट्रोजन (\[2{s^2}2{p^4}\] , वर्ग \[15\] ) की
संयोजकता \[3\] है। इसलिये दोनों के मध्य बना द्विअंगी यौगिक \[M{g_3}{N_2}\] है।
(ग) ऐलुमिनियम और आयोडीन
उत्तर: ऐलुमिनियम ((\[3{s^2}3{p^1}\],\[13\] समूह) की संयोजकता 3 है, जबकि आयोडीन (\[5{s^2},{\text{ }}5{p^5},\] वर्ग \[17\] ) की संयोजकता \[1\] है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक \[Al{I_3}\] है।
(घ) सिलिकन और ऑक्सीजन
उत्तर: सिलिकॉन (\[3{s^2}3{p^2}^{}\] , वर्ग \[14\] ) की संयोजकता 4 है, जबकि ऑक्सीजन (\[2{s^2}2{p^4}\], वर्ग\[17\]) की संयोजकता \[2\] है। इसलिए दोनों के मध्य बना द्विअंगी यौगिक \[Si{O_2}\] है।
(ङ) फॉस्फोरस और फ्लुओरीन
उत्तर: फॉस्फोरस ((\[3{s^2}3{p^3}\], वर्ग\[15\]) की संयोजकता \[3\] तथा \[5\] है, जबकि फ्लुओरीन ((\[2{s^2}2{p^4}\], , वर्ग \[17\]) की संयोजकता \[1\] है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक \[P{F_3}\] अथवा \[P{F_5}\]है।
(च) 71वाँ तत्व और फ्लुओरीन
उत्तर: तत्त्व जिसका परमाणु क्रमांक \[71(4{f^{14}}5{d^1}6{s^2})\] है, एक लैन्थेनाइड है तथा ल्यूटीशियम : (\[Lu\]) है। यह वर्ग \[3\]में स्थित है। इसकी संयोजकता \[3\] है। फ्लु ओरीन (\[2{s^2}2{p^5}\], वर्ग \[17\] ) की संयोजकता \[1\] है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक \[LuF\] है।
33. आधुनिक आवर्त सारणी में आवर्त निम्नलिखित में से किसको व्यक्त करता है?
(क) परमाणु संख्या
(ख) परमाणु द्रव्यमान
(ग) मुख्य क्वाण्टम संख्या
(घ) दिगंशी क्वाण्टम संख्या
उत्तर: (ग) मुख्य क्वाण्टम संख्या
आधुनिक आवर्त सारणी में, प्रत्येक आवर्त एक नवीन कक्ष के भरने के साथ प्रारम्भ होता है।
34. आधुनिक आवर्त सारणी के लिए निम्नलिखित के सन्दर्भ में कौन-सा कथन सही नहीं है।
(क) \[p - \] ब्लॉक में \[6\] स्तम्भ हैं, क्योंकि \[p - \]कोश के सभी कक्षक भरने के लिए अधिकतम \[6\] इलेक्ट्रॉनों की आवश्यकता होती है।
(ख) \[d\]ब्लॉक में $8$ स्तम्भ हैं, क्योंकि \[d\]उपकोश के कक्षक भरने के लिए अधिकतम $8$ इलेक्ट्रॉनों की आवश्यकता होती है।
(ग) प्रत्येक ब्लॉक में स्तम्भों की संख्या उस उपकोश में भरे जा सकने वाले इलेक्ट्रॉनों की संख्या के बराबर होती है।
(घ) तत्व के इलेक्ट्रॉन विन्यास को भरते समय अन्तिम भरे जाने वाले इलेक्ट्रॉन को उपकोश उसके दिगंशी क्वाण्टम संख्या को प्रदर्शित करता है।
उत्तर: कथन (ख) असत्य है। \[d - \] ब्लॉक में $8$ स्तम्भ हैं क्योंकि एक \[d\]-उपकक्ष में अधिकतम $10$ इलेक्ट्रॉन ही व्यवस्थित हो सकते हैं।
35. ऐसा कारक, जो संयोजकता इलेक्ट्रॉन को प्रभावित करता है, उस तत्व की रासायनिक , प्रवृत्ति भी प्रभावित करता है। निम्नलिखित में से कौन-सा कारक संयोजकता कोश को
प्रभावित नहीं करता?
(क) संयोजक मुख्य क्वाण्टम संख्या (\[n\])
(ख) नाभिकीय आवेश (\[z\])
(ग) नाभिकीय द्रव्यमान
(घ) क्रोड इलेक्ट्रॉनों की संख्या
उत्तर: नाभिकीय द्रव्यमान। नाभिकीय द्रव्यमान संयोजकता कोश को प्रभावित नहीं करता है।
36. समइलेक्ट्रॉनिक स्पीशीज \[{{\mathbf{F}}^--},{\text{ }}{\mathbf{Ne}}\] और \[N{a^ + }\] का आकार इनमें से किससे प्रभावित : होता है?
(क) नाभिकीय आवेश (\[z\])
(ख) मुख्य क्वाण्टम संख्या (\[n\])
(ग) बाह्य कक्षकों में इलेक्ट्रॉन-इलेक्ट्रॉन अन्योन्यक्रिया
(घ) ऊपर दिए गए कारणों में से कोई भी नहीं, क्योंकि उनका आकार समान है।
उत्तर: नाभिकीय आवेश। समइलेक्ट्रॉनिक आयनों की त्रिज्या नाभिकीय आवेश के बढ़ने पर घटती है। दी गई समइलेक्ट्रॉनिक स्पीशीज में विभिन्न नाभिकीय आवेश हैं और इस प्रकार उनके आकार भिन्न हैं। इनका आकार निम्न क्रम में घटता है-
\[F--{\text{ }}\left( { + 9} \right) > {\text{ }}Ne\left( { + 10} \right) > {\text{ }}N{a^ + }\left( { + 11} \right)\]
37. आयनन एन्थैल्पी के सन्दर्भ में निम्नलिखित में से कौन-सा असत्य/गलत है?
(क) प्रत्येक उत्तरोत्तर इलेक्ट्रॉन से आयनन एन्थैल्पी बढ़ती है।
(ख) क्रोड उत्कृष्ट गैस के विन्यास से जब इलेक्ट्रॉन को निकाला जाता है, तब आयनन एन्थैल्पी का मान अत्यधिक होता है।
(ग) आयनन एन्थैल्पी के मान में अत्यधिक तीव्र वृद्धि संयोजकता इलेक्ट्रॉनों के विलोपन को व्यक्त करती है।
(घ) कम मान वाले कक्षकों से अधिक \[n\]मान वाले कक्षकों की तुलना में इलेक्ट्रॉनों को आसानी से निकाला जा सकता है।
उत्तर: कथन (घ) असत्य है। अधिक » मान वाले कक्षकों से इलेक्ट्रॉनों को आसानी से निकाला जा सकता है, क्योंकि निकलने वाला इलेक्ट्रॉन नाभिक से दूर होता है।
38. \[B,{\text{ }}AI,{\text{ }}Mg,{\text{ }}K\] तत्वों के लिए धात्विक अभिलक्षण का सही क्रम इनमें कौन-सा है?
(क) \[{\mathbf{B}}{\text{ }} > {\text{ }}{\mathbf{Al}} > {\text{ }}{\mathbf{Mg}}{\text{ }} > {\text{ }}{\mathbf{K}}\]
(ख) \[{\mathbf{Al}} > {\text{ }}{\mathbf{Mg}}{\text{ }} > {\text{ }}{\mathbf{B}}{\text{ }} > {\text{ }}{\mathbf{K}}\]
(ग) \[{\mathbf{Mg}}{\text{ }} > {\text{ }}{\mathbf{Al}} > {\text{ }}{\mathbf{K}}{\text{ }} > {\text{ }}{\mathbf{B}}\]
(घ) \[{\mathbf{K}}{\text{ }} > {\text{ }}{\mathbf{Mg}}{\text{ }} > {\text{ }}{\mathbf{Al}} > {\text{ }}{\mathbf{B}}\]
उत्तर: (घ) \[{\mathbf{K}}{\text{ }} > {\text{ }}{\mathbf{Mg}}{\text{ }} > {\text{ }}{\mathbf{Al}} > {\text{ }}{\mathbf{B}}\]
यह क्रम इसलिए सही है क्योंकि धात्विक गुण आवर्त में आगे बढ़ने पर घटता है। इसलिए, \[{\mathbf{Al}}\], \[{\mathbf{Mg}}{\text{ }}\]तथा \[{\mathbf{K}}\]के धात्विक गुण इस क्रम में होंगे- \[{\mathbf{K}}{\text{ }} > {\text{ }}{\mathbf{Mg}}{\text{ }} > {\text{ }}{\mathbf{Al}}\]। इसके अतिरिक्त धात्विक गुण एक वर्ग में नीचे जाने पर बढ़ते हैं। अत: B को Al की तुलना में कम धात्विक होना चाहिए।
39. तत्वों \[B,{\text{ }}C,{\text{ }}N,{\text{ }}F,Si\] के लिए अधातु अभिलक्षण का इनमें से सही क्रम कौन-सा है?
(क) \[{\mathbf{B}}{\text{ }} > {\text{ }}{\mathbf{C}} > {\text{ }}{\mathbf{Si}} > {\text{ }}{\mathbf{N}}{\text{ }} > {\text{ }}{\mathbf{F}}\]
(ख) \[{\mathbf{Si}} > {\text{ }}{\mathbf{C}} > {\text{ }}{\mathbf{B}}{\text{ }} > {\text{ }}{\mathbf{N}}{\text{ }} > {\text{ }}{\mathbf{F}}\]
(ग) \[{\mathbf{F}} > {\text{ }}{\mathbf{N}}{\text{ }} > {\text{ }}{\mathbf{C}} > {\text{ }}{\mathbf{B}}{\text{ }} > {\text{ }}{\mathbf{Si}}\]
(घ) \[{\mathbf{F}}{\text{ }} > {\text{ }}{\mathbf{N}}{\text{ }} > {\text{ }}{\mathbf{C}}{\text{ }} > {\text{ }}{\mathbf{Si}}{\text{ }} > {\text{ }}{\mathbf{B}}\]
उत्तर: (ग) \[{\mathbf{F}} > {\text{ }}{\mathbf{N}}{\text{ }} > {\text{ }}{\mathbf{C}} > {\text{ }}{\mathbf{B}}{\text{ }} > {\text{ }}{\mathbf{Si}}\]
यह इसलिए है क्योकि अधातु अभिलक्षण एक आवर्त में बायें से । दायें ओर जाने पर बढ़ते हैं तथा वर्ग में नीचे जाने पर घटते हैं।
40. तत्वों \[F,{\text{ }}Cl,{\text{ }}O,N\] तथा ऑक्सीकरण गुणधर्मों के आधार पर उनकी रासायनिक अभिक्रियाशीलता का क्रम निम्नलिखित में से कौन-से तत्वों में है?
(क) \[{\mathbf{F}}{\text{ }} > {\text{ }}{\mathbf{Cl}} > {\text{ }}{\mathbf{O}}{\text{ }} > {\text{ }}{\mathbf{N}}\]
(ख) \[{\mathbf{F}} > {\text{ }}{\mathbf{O}} > {\text{ }}{\mathbf{Cl}} > {\text{ }}{\mathbf{N}}\]
(ग) \[{\mathbf{Cl}} > {\text{ }}{\mathbf{F}} > {\text{ }}{\mathbf{O}}{\text{ }} > {\text{ }}{\mathbf{N}}\]
(घ) \[{\mathbf{O}} > {\text{ }}{\mathbf{F}} > {\text{ }}{\mathbf{N}}{\text{ }} > {\text{ }}{\mathbf{Cl}}\]
उत्तर: (ख) \[{\mathbf{F}} > {\text{ }}{\mathbf{O}} > {\text{ }}{\mathbf{Cl}} > {\text{ }}{\mathbf{N}}\]
तत्त्वों का ऑक्सीकारक गुणधर्म एक आवर्त में बायें से दायें चलने पर बढ़ता है तथा वर्ग में नीचे जाने पर घटता है। ऑक्सीजन \[{\mathbf{Cl}}\]की तुलना में एक प्रबल ऑक्सीकारक पदार्थ है क्योंकि \[{\mathbf{O}}\]अधिक विद्युत ऋणात्मक है।
41.\[{_{{\mathbf{35}}}^{{\mathbf{79}}}}{\mathbf{Br}}\]तथा \[^{{\mathbf{79}}}{\mathbf{Br}}\] प्रतिक मान्य है ,जबकि\[{_{{\mathbf{79}}}^{{\mathbf{35}}}}{\mathbf{Br}}\] तथा \[^{{\mathbf{35}}}{\mathbf{Br}}\] मान्य नहीं है। संक्षेप में कारण बताइए।
उत्तर: एक तत्व के लिए परमाणु संख्या का मान स्थिर होता है लेकिन द्रव्यमान संख्या का मान तत्व के समस्थानिक प्रकृति पर निर्भर करता है। अतः द्रव्यमान संख्या को प्रतिक के साथ दर्शाना आवश्यक हो जाता है। परम्परा के अनुसार तत्व के प्रतिक में द्रव्यमान संख्या को ऊपर बांये एवं परमाणु संख्या को नीचे बांये ओर इस प्रकार लिखा जाता है – \[{_Z^A}X\]
NCERT Solutions for Class 11 Chemistry Chapter 3 Classification of Elements and Periodicity in Properties in Hindi
Chapter-wise NCERT Solutions are provided everywhere on the internet with an aim to help the students to gain a comprehensive understanding. Class 11 Chemistry Chapter 3 solution Hindi mediums are created by our in-house experts keeping the understanding ability of all types of candidates in mind. NCERT textbooks and solutions are built to give a strong foundation to every concept. These NCERT Solutions for Class 11 Chemistry Chapter 3 in Hindi ensure a smooth understanding of all the concepts including the advanced concepts covered in the textbook.
NCERT Solutions for Class 11 Chemistry Chapter 3 in Hindi medium PDF download are easily available on our official website (vedantu.com). Upon visiting the website, you have to register on the website with your phone number and email address. Then you will be able to download all the study materials of your preference in a click. You can also download the Class 11 Chemistry Classification of Elements and Periodicity in Properties solution Hindi medium from Vedantu app as well by following the similar procedures, but you have to download the app from Google play store before doing that.
NCERT Solutions in Hindi medium have been created keeping those students in mind who are studying in a Hindi medium school. These NCERT Solutions for Class 11 Chemistry Classification of Elements and Periodicity in Properties in Hindi medium pdf download have innumerable benefits as these are created in simple and easy-to-understand language. The best feature of these solutions is a free download option. Students of Class 11 can download these solutions at any time as per their convenience for self-study purpose.
These solutions are nothing but a compilation of all the answers to the questions of the textbook exercises. The answers/ solutions are given in a stepwise format and very well researched by the subject matter experts who have relevant experience in this field. Relevant diagrams, graphs, illustrations are provided along with the answers wherever required. In nutshell, NCERT Solutions for Class 11 Chemistry in Hindi come really handy in exam preparation and quick revision as well prior to the final examinations.
FAQs on NCERT Solutions For Class 11 Chemistry In Hindi Chapter 3 Classification Of Elements And Periodicity In Properties - 2025-26
1. How do the NCERT Solutions for Class 11 Chemistry Chapter 3 help in mastering the periodic table?
Vedantu's NCERT Solutions for Class 11 Chemistry Chapter 3 provide a clear, step-by-step methodology for understanding the periodic table. They break down complex concepts like the modern periodic law and the arrangement of elements into simple, understandable steps. By following these solutions, students can effectively practise solving questions related to locating elements and predicting their properties, ensuring a thorough grasp of the chapter for the 2025-26 CBSE exams.
2. What key topics from Chapter 3 are covered in the Vedantu NCERT Solutions?
The NCERT Solutions for this chapter cover all essential topics as per the latest CBSE syllabus. Key areas include:
- The significance of classification and the modern periodic law.
- Predicting the group, period, and block of an element.
- Detailed explanations for periodic trends in properties like atomic radii, ionic radii, ionization enthalpy, electron gain enthalpy, and electronegativity.
- Solving problems based on exceptions to these periodic trends.
- The IUPAC nomenclature for elements with atomic numbers greater than 100.
3. How do the NCERT Solutions explain the step-by-step method for predicting the group, period, and block of an element?
The solutions provide a systematic method. First, you write the full electronic configuration of the element based on its atomic number. The principal quantum number (n) of the valence shell directly gives you the period. The subshell (s, p, d, or f) that receives the last electron determines the block. Finally, the solutions show how to use a block-specific formula (e.g., for p-block, Group No. = 10 + no. of valence electrons) to find the correct group.
4. What is the correct approach, as per NCERT Solutions, to solve problems comparing the ionic radii of isoelectronic species?
The NCERT Solutions teach a two-step approach for comparing the radii of isoelectronic species (ions with the same number of electrons). First, confirm that the species are indeed isoelectronic. Second, compare their nuclear charge (number of protons). The ion with the highest nuclear charge will have the strongest attraction for the electrons, pulling them closer and resulting in the smallest ionic radius. Conversely, the ion with the lowest nuclear charge will be the largest.
5. Why is it crucial to follow the detailed steps in NCERT Solutions for questions on exceptions in ionization enthalpy?
Following the detailed steps is crucial because exam questions often target these exceptions. The NCERT Solutions explain the 'why' behind them, such as the extra stability of half-filled (p³, d⁵) and fully-filled (p⁶, d¹⁰) electronic configurations. For example, they clarify why beryllium has a higher first ionization enthalpy than boron. This detailed reasoning helps students write complete answers and avoid losing marks for incomplete explanations.
6. How do the solutions for Chapter 3 link an element's electronic configuration to its chemical properties and valency?
The solutions consistently demonstrate that an element's valence shell electronic configuration is the key to its chemical behaviour. For every problem, they show how this configuration determines an element's tendency to lose, gain, or share electrons. This directly explains its valency, metallic or non-metallic character, and the type of compounds it forms, thus connecting the fundamental structure to observable properties.
7. Beyond just providing answers, what problem-solving strategies do the NCERT Solutions for Chapter 3 teach for predicting periodic trends?
The solutions teach a strategic approach rather than rote memorisation. For any trend (like electronegativity or atomic size), they guide students to first identify the primary influencing factors, such as nuclear charge and atomic radius. Then, they show how to analyse the interplay of these factors across a period or down a group. This strategy allows students to reason out the correct answer for any given set of elements, even unfamiliar ones.
8. How do the NCERT Solutions demonstrate the IUPAC nomenclature for elements with atomic numbers greater than 100?
The solutions clearly illustrate the IUPAC system by breaking it down into simple rules. They explain how to use the numerical roots for digits 0-9 (e.g., 'un' for 1, 'nil' for 0, 'bi' for 2). The answer demonstrates how to combine these roots in the order of the digits of the atomic number and then add the suffix '-ium'. For example, for Z=104, the solution would show the steps to form the name Unnilquadium (Unq).



















